Библиотека структурных гетероциклических аналогов, содержащих имидный и сульфонильный фрагменты
М. В. Дорогов, Л. А. Савватеева, И. В. Тюнёва
В последние годы проводится все больше исследований, связанных с разработкой методов синтеза органических соединений, обладающих определёнными типами биологической активности и являющихся разнообразными лекарственными препаратами (1,2). Согласно литературным данным, предпочтение в этих исследованиях отдается гетероциклическим системам, содержащим атомы кислорода, серы, азота и широкое разнообразие функциональных заместителей (3-5). Одна из причин использования гетероциклических соединений - это широкие возможности их структурной модификации, а, следовательно, получение соединений с новым комплексом биохимических свойств. Одним из вариантов модификации гетероциклических структур является введение различных фрагментов и функциональных групп в качестве заместителей. Поэтому для современной медицинской химии особый интерес представляют комбинаторные библиотеки структурных аналогов с однотипным гетероциклическим скелетом и варьирующимися фрагментами и функциональными группами.
Целью данной работы являлось генерирование библиотеки структурных аналогов гетероциклического типа, содержащих одновременно имидный и сульфонильный фрагменты, идентификация синтезированных соединений и компьютерная оценка их биологической активности с помощью системы PASS (6,7).
Известно, что оба вышеупомянутых структурных фрагмента используются в направленном поиске биологически активных препаратов. Так, в частности, известен имидосодержащий препарат СЕДИЕЛ(r), являющийся эффективным антидепрессантом, а ароматические сульфокислоты считаются перспективными билдинг-блоками для получения различных химиотерапевтических средств (8,9).
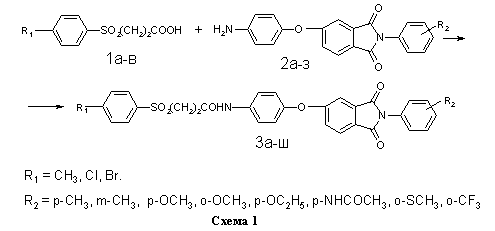
На схеме 1 представлена реакция получения библиотеки структурных аналогов с имидным и сульфонильным фрагментами 3а-ш. В качестве реагентов были использованы ароматические сульфопропионовые кислоты 1а-в и аминофенокси-N-фенилфталимиды 2а-з (таблица).
Соединения 1a-в получали на основе толуола, хлор- и бромбензола по методикам, изложенным в работах (10,11) (схема 2).
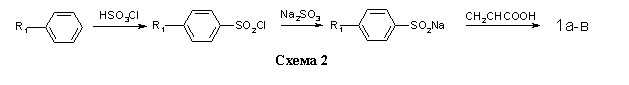
Соединения 2а-з получали на основе п-нитрохлорбензола и 3,4-ксиленола, через стадии образования 4-нитро-3/,4/диметилдифени-локсида 4, 4-нитрофеноксифталевой кислоты 5 и нитрофенокси-N-фенилфталимидов 6а-з (схема 3) по методикам, изложенным в работах (12,13).

Для получения библиотеки структурных аналогов 3а-ш использованы две метода ацилирования аминов 2а-з. В первом случае (метод А, см. Экспериментальную часть) в качестве активированного ацилирующего агента использовались хлорангидриды кислот, полученных обработкой 1а-в тионилхлоридом в бензоле (схема 4).

Во втором случае (метод Б, см. Экспериментальную часть) в качестве электрофильного ацилирующего агента использовались не хлорангидриды кислот 7а-в, а их имидазолилы 8а-в, полученные взаимодействием 1а-в с N,N-карбонилдиимдазолом 9 в безводном диоксане. Ввиду малой основности 9 и слабого характера амидной связи в имидазолилах 8а-в, последние легко вступают в реакцию переамидизации с аминами 2а-з (схема 5).

Данный метод находит в последнее время всё большее использование в органическом синтезе. Его очевидным преимуществом является отсутствие необходимости в использовании высокотоксичного тионилхлорида для получения активного ацилирующего агента и лёгкость очистки целевого продукта от побочного имидазола.
Таблица
| Соединение | R1 | R2 | Метод получения и способ очистки | Выход, % | Температура плавления, °С |
| 1а | CH3 | (10,11), кр. из этанол+вода | 80 | 113...5 | |
| 1б | Cl | - | 75 | 145...6 | |
| 1в | Br | - | 80 | 154...6 | |
| 2а | p-CH3 | (12,13 ) | 70 | 181...3 | |
| 2б | m-CH3 | - | 75 | 166...8 | |
| 2в | p-OCH3 | - | 75 | 194...5 | |
| 2г | o-OCH3 | - | 70 | 202...4 | |
| 2д | p-OC2H5 | - | 75 | 195...7 | |
| 2е | p-NHCOCH3 | - | 65 | 198...200 | |
| 2ж | o-SCH3 | - | 70 | 158...9 | |
| 2з | o-CF3 | - | 70 | 190...3 | |
| 3а | CH3 | p-CH3 | А, крист. в этаноле | 80 | 257...8 |
| 3б | - | m-CH3 | - | 80 | 187...9 |
| 3в | - | p-OCH3 | 85 | 222...4 | |
| 3г | - | o-OCH3 | А, крист. в изопропаноле | 75 | 253...6 |
| 3д | - | p-OC2H5 | Б, крист. в изопропаноле | 75 | 201...4 |
| 3е | - | p-NHCOCH3 | Б, крист. в пропанол+ДМФА | 70 | 260...2 |
| 3ж | - | o-SCH3 | Б, экстр. бензолом | 80 | 219...21 |
| 3з | - | o-CF3 | - | 85 | 197...9 |
| 3и | Cl | p-CH3 | А, крист. в этаноле | 85 | 202...4 |
| 3к | - | m-CH3 | - | 80 | 184...6 |
| 3л | - | p-OCH3 | - | 85 | 269...71 |
| 3м | - | o-OCH3 | А, крист. в диоксан+вода | 80 | 225...7 |
| 3н | - | p-OC2H5 | Б, крист. в диоксан+вода | 70 | 259...61 |
| 3о | - | p-NHCOCH3 | Б, крист. в пропанол+ДМФА | 70 | 272...5 |
| 3п | - | o-SCH3 | Б, крист. в изопропаноле | 75 | 178...80 |
| 3р | - | o-CF3 | Б, крист. в изопропаноле | 70 | 185...7 |
| 3с | Br | p-CH3 | А, экстр. диэтил. эфиром | 75 | 253...7 |
| 3т | - | m-CH3 | А, экстр. диэтил. эфиром | 70 | 212...4 |
| 3у | - | p-OCH3 | А, крист. в диоксан+вода | 65 | 265...7 |
| 3ф | - | o-OCH3 | А, крист. в диоксан+вода | 65 | 137...9 |
| 3х | - | p-OC2H5 | Б, крист. в изопропаноле | 70 | 249...50 |
| 3ц | - | p-NHCOCH3 | Б, крист. в пропанол+ДМФА | 70 | 279...82 |
| 3ч | - | o-SCH3 | Б, экстр. бензолом | 75 | 164...7 |
| 3ш | - | o-CF3 | - | 80 | 209...11 |
