Органическая химия
Контрольная работа №1
1 Приведите проекционные формулы оптических изомеров соединений
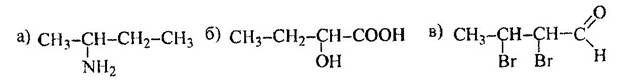
Определите, число изомеров и укажите, какие из них являются энантиомерами, а какие – диастереомерами.
Решение
а). Число изомеров – 2, оба изомера являются по отношению друг к другу энантиомерами.
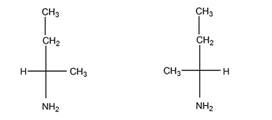
б). Число изомеров – 2, оба - энантиомеры
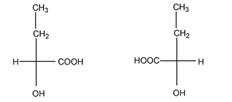
в). Число изомеров – 4.
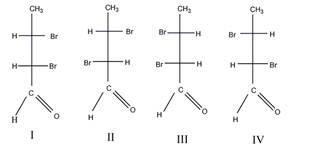
Пары энантиомеров: I и III, II и IV; пары диастереомеров: I и II, III и IV.
2 Приведите механизм реакции радикального замещения (SR) на примере бромирования 2-метилпропана и циклогексана. Объясните устойчивость третичного радикала по сравнению с вторичным и первичным
Решение
Механизм бромирования 2-метилпропана
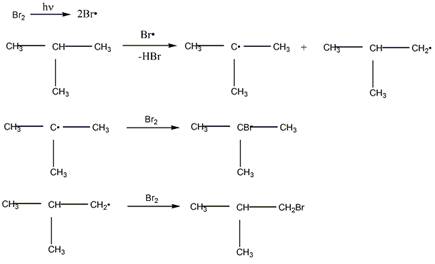
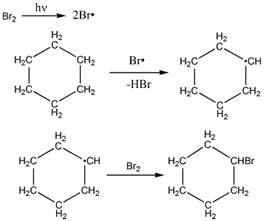
Механизм бромирования циклогексанаость свободных радикалов определяется энергией их образования из алканов. Энергия, необходимая для образования различных типов радикалов, уменьшается в следующем порядке: СН3 > первичный > вторичный > третичный. Если для образования одного радикала требуется меньше энергии, чем для образования другого, то это может означать только то, что в сравнении с образующимся алканом один радикал содержит меньше энергии и более устойчив, чем другой (см. рисунок ниже):
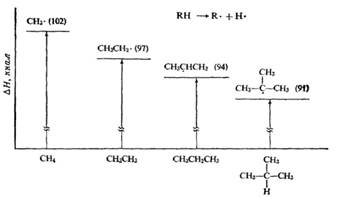
Абсолютное содержание энергии, например, метильного и этильного радикалов не сравнивается; просто говорят, что различие в энергиях между метаном и метильным радикалом больше, чем между этаном и этильным радикалом.
3 Дайте определение понятию «кислотности» органических соединений по Бренстеду-Лоури и расположите в ряд по возрастанию кислотных свойств следующие соединения: фенол, пропантиол-1, пропиловый спирт, пропановая кислота, пропан, пропанамин-1.
Укажите вид и знак электронных эффектов заместителей. Обоснуйте кислотные свойства указанных веществ, исходя из стабильности соответствующих анионов
Решение
По теории Брёнстеда (протолитической теории) кислотность и основность соединений связывается с переносом протона Н. Кислота <-> Н + Основание. Кислота и основание образуют сопряженную кислотно-основную пару, в которой чем сильнее кислота, тем слабее сопряженное ей основание, и напротив, чем сильнее основание, тем слабее сопряженная ему кислота. Например, хлороводородная кислота сильнее, чем уксусная кислота и соответственно ацетат-ион будет более сильным основанием, чем хлорид-ион. Кислоты Брёнстеда (протонные кислоты) нейтральные молекулы или ионы, способные отдавать протон (доноры протонов). Основания Брёнстеда — нейтральные молекулы или ноны, способные присоединить протон (акцепторы протонов). Кислотность и основность являются не абсолютными, а относительными свойствами соединений: кислотные свойства обнаруживаются лишь в присутствии основания; основные свойства только в присутствии кислоты.
Большинство органических соединений можно рассматривать как кислоты, поскольку в них содержатся поляризованные связи атома водорода с различными элементами (О, N, S, С). Органические кислоты классифицируют по природе кислотного центра:
ОН-кислоты: спирты, фенолы, карбоновые кислоты, сульфокислоты, гидроксикислоты, аминокислоты;
· SH-кислоты: тиоспирты, SH-содержащие аминокислоты и др. соединения;
· NH-кислоты: амины, имины, гетероциклические соединения с атомом азота;
· СН-кислоты: углеводороды, радикалы гетерофункциональных соединений.
Для количественной характеристики кислотных свойств используется величина
pKa = - lg Ka,
где Ка – константа кислотности. Чем меньше рКа, тем больше кислотность по Бренстеду.
Качественной характеристикой кислотных свойств может служить стабильность образующегося аниона. Сила кислоты определяется стабильностью аниона, образующегося из этой кислоты: чем стабильнее анион, тем сильнее кислота. Стабильность аниона, в свою очередь, определяется характером распределения отрицательного заряда аниона и зависит от ряда факторов:
1) природы атома в кислотном центре (электроотрицательности и поляризуемости элемента);
2) характера связанного с кислотным центром органического радикала (электроноакцепторного или электронодонорного);
3) сольватационных эффектов.
Электроотрицательность имеет значение, когда сравнивается кислотность соединений, имеющих одинаковые радикалы и элементы кислотного центра, относящиеся к одному и тому же периоду периодической системы Д.И. Менделеева (т.е. когда практически не изменяется поляризуемость). Чем более электроотрицательным является элемент в кислотном центре, тем он более способен нести отрицательный заряд, и тем стабильнее образующийся анион, и соответственно, сильнее кислота.
С—Н кислота | N—H кислота | О—Н кислота | S—H кислота | О—Н кислоты | |
С2Н5СH2←Н пропан |
С3Н7N←H пропанамин | С3Н7О←Н Пропиловый спирт | С2Н5S←H Пропантиол-1 | С6Н5О←Н фенол | С2Н5СОО←Н уксусная кислота |
рКа =50 | рКа ≈ 30 | рКа ≈ 18 | рКа ≈ 12 | рКа = 10 | рКа = 4,9 |
