Определение фенолов воде
Введение
Цель технического отчета заключается в определении уровня загрязнения воды на очистных сооружениях города Троицка.
Для выполнения технического отчета я поставил перед собой следующие задачи:
· Закрепить фотоколориметрический метод на производстве
· с использованием данного метода найти концентрацию нитритов и фосфатов
Фосфаты применяют в многочисленных промышленных областях:
· электротехника,
· нефтедобыча,
· производство лакокрасочных
· и строительных материалов,
· некоторых видов покрытий.
Фосфаты являются необходимой составляющей оптического и некоторых других видов стекол, а также фарфора. В медицине, в частности в стоматологии, фосфаты используются в качестве элемента для изготовления стоматологического цемента. Фосфаты нашли свое применение в тяжелой промышленности: металлообработка, литейное производство. Фосфаты нужны и в производстве различного вида текстильного, кожаного материалов, фотоматериалов, бумаги.При изготовлении моющих средств используют способность фосфатов к растворению минеральных загрязнений и смягчению воды. Однако во многих Западных странах применение многих видов фосфатов (технический тринатрийфосфат, например) ограничено или вовсе запрещено.Связано это в первую очередь с негативным воздействием фосфатов на окружающую среду, особенно на водоемы. Биогенные элементы (азот и фосфор) при попадании в закрытую водную среду, катализируют активный рост сине-зеленых водорослей. Эвтрофикация приводит к значительному ухудшению качества воды и повышает ее токсичность. Это опасно не только для населяющих водоемы рыб и беспозвоночных, но и для человека, употребляющего воду. Современная химическая наука совершила истинный прорыв, предложив использовать биологически инертные вещества – цеолиты в качестве альтернативы фосфатам. Более четверти века цивилизованный мир использует именно такие бесфосфатные порошки. Однако Российский рынок по-прежнему переполнен порошками тех же торговых марок, но произведенных на более дешевой фосфатной основе. Использовать фосфатные моющие средства или нет – вопрос сугубо индивидуальный. Но необходимо понимать и помнить, что вода – это наше общее достояние, утрата которого практически невосполнима.
вода заказник загрязнение фенол
1.Литературный обзор
1.1 Характеристика анализируемого объекта
1.1.1 Характеристика воды
Вода (оксид водорода) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях). Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд на полюсах).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Физические свойства воды
К основным физическим свойствам воды относят цвет, запах, вкус, прозрачность, плотность, сжимаемость, вязкость и электропроводность.
Цвет подземных вод зависит от их химического состава и механических примесей. Обычно подземные воды бесцветны. Желтоватый цвет характерен для вод болотного происхождения, содержащих гуминовые вещества. Сероводородные воды вследствие окисления H2S и образования тонкой коллоидной мути, состоящей из частиц серы, имеют изумрудный оттенок. Цвет воды оценивается по стандартной платино-кобальтовой шкале в градусах.
Запах в подземных водах обычно отсутствует. Ощущение запаха свидетельствует или о наличии газов биохимического происхождения (сероводород и др.), или о присутствии гниющих органических веществ. Характер запаха выражают описательно: без запаха, сероводородный, болотный, гнилостный, плесневелый и т.д. Интенсивность запаха оценивают по шкале в баллах.
Вкус воды зависит от состава растворенных веществ. Соленый вкус вызывается хлористым натрием, горький - сульфатом магния, ржавый - солями железа. Сладковатый вкус имеют воды, богатые органическими веществами, наличие свободной углекислоты придает приятный освежающий вкус. Вкус воды оценивается по таблицам в баллах.
Прозрачность подземных вод зависит от количества растворенных в них минеральных веществ, содержания механических примесей, органических веществ и коллоидов. Для указания степени прозрачности подземных вод служит следующая номенклатура: прозрачная, слабопалесцирующая, опалесцирующая, слегка мутная, мутная, сильно мутная. Мутность воды оценивается в мг\л по стандартной шкале.
Плотность воды определяется отношением ее массы к объему при определенной температуре. За единицу плотности воды принята плотность дистиллированной воды при температуре 4°С. Плотность воды зависит от температуры, количества растворенных в ней солей, газов и взвешенных частиц и изменяется от 1 до 1,4 г/см3.
Сжимаемость воды незначительна и характеризуется коэффициентом сжимаемости β = (2,7-5)10-5 Па. Вязкость воды характеризует внутреннее сопротивление частиц жидкости ее движению, количественно она выражается коэффициентами динамической и кинематической вязкости.
Электропроводность подземных вод зависит от количества растворенных в них солей. Пресные воды обладают незначительной электропроводностью. Дистиллированная вода является изолятором. Электропроводность воды оценивают по удельному электрическому сопротивлению, которое выражается в Ом.м и изменяется от 0,02 до 1,0 Ом.м.
Таблица
| № п/п | Физические константы | Н2О |
| 1 | Молярная масса (г/моль) | 18,015 |
| 2 | Плотность при 20оС | 0,99823 |
| 3 | Температура максимальной плотности, оС | 4 |
| 4 | Температура кипения, оС | 100 |
| 5 | Температура замерзания, оС | 0 |
Химические свойства воды
Химические свойства воды определяются особенностями ее строения. Вода довольно устойчивое вещество, она начинает разлагаться на водород и кислород при нагревании по крайней мере до 1000°С ( происходит термическая диссоциация) или под действием ультрафиолетового излучения (фотохимическая диссоциация). Вода относится к химически активным соединениям. Например, реагирует с фтором. Хлор при нагревании или на свету разлагает воду с выделением атомарного кислорода:
H2O + Cl2 = HCl + HClO (НСlО = НСl + О)
При обычных условиях она взаимодействует с активными металлами:
2H2O + Ca = Ca(ОН)2 + H2
2H2O + 2Na = 2NaOH + H2
Вода вступает в реакцию и со многими неметаллами. Например, при взаимодействии с атомарным кислородом образуется пероксид водорода:
H2O + O = H2O2
Многие оксиды реагируют с водой, образуя основания и кислоты:
CO2 + H2O = H2CO3
CaO + H2O = Ca(OH)2
При взаимодействии с некоторыми солями образуются кристаллогидраты. При нагревании они теряют кристаллизационную воду:
Na2CO3 + 10H2O = Na2CO3 * 10H2O.
Вода также разлагает большинство солей. (1,с.112)
1.1.2 Характеристика фенолов
К фенолам относятся органические соединения с гидроксидной группой в бензольном кольце.
Фенолы присутствуют в бытовых сточных водах и в разнообразных производственных сточных водах химических, нефтеперерабатывающих, нефтехимических, лесохимических, коксохимических, фармацевтических, металлургических, шпалопропиточных, анилинокрасочных и других производств.
В естественных условиях фенолы образуются в процессе метаболизма водных организмов, при биохимическом распаде и трансформации органических веществ.
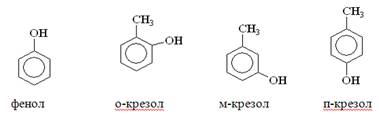
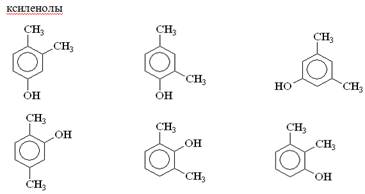
Фенолы делят на две группы: летучие с паром и нелетучие.
Летучие с паром - это ряд соединений, перегоняющихся с водяным паром.
Рис
Рис

Рис
Летучие с паром фенолы являются основным компонентом фенольных сточных вод, и вместе с ними они попадают в канализационную сеть и в поверхностные воды, загрязняя их.
Летучие с паром фенолы более токсичные, обладают более интенсивным запахом, чем нелетучие, поэтому допустимые концентрации их в водоемах чрезвычайно малы.
Особенно жесткие требования предъявляются к воде, поступающей на водопроводные станции, где она подвергается обработке хлорированием, потому что хлорпроизводные фенола, О – крезолы, м – крезол имеют неприятный запах даже в самых малых концентрациях.
Для летучих с паром фенолов предельно допустимая концентрация (ПДК) 0,001 мг/л
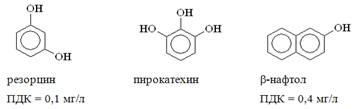
Нелетучие фенолы
Рис
Так как значения ПДК для разных фенолов различно, то их определяют раздельно.
Физические свойства
Большинство фенолов — бесцветные твердые вещества. Сам фенол плавится при t°=41°C. Присутствие воды в феноле понижает его температуру плавления. Смесь фенола с водой при комнатной температуре — жидкость. Фенол обладает характерным запахом. Если при комнатной температуре фенол растворим в воде незначительно, то при нагревании до 70°С он растворяется полностью.
Фенол — антисептик, его водный раствор используется для дезинфекции и называется карболовой кислотой. Фенол не самый подходящий антисептик, так как вызывает ожоги кожи, а пары его токсичны. Многочисленными исследованиями было установлено, что некоторые замещенные фенолы являются более удобными антисептиками, чем сам фенол. Одно из наиболее употреби-тельных соединений — 2,4,6-трихлорфенол. (2, с.87)
Способы получения фенолов
1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
С6Н5―Сl + 2NaOH → C6H5―ONa + NaCl + Н2О.
2. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха образуются фенол и ацетон:
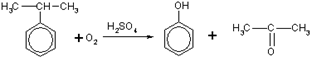
Рис
Это — основной промышленный способ получения фенола.
3. Получение из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот с щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:
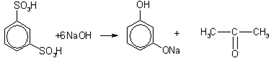
Рис
Влияние на организм
Практически сразу после получения фенола ученые установили, что это химическое вещество обладает не только полезными свойствами, что позволяет его использовать в различных сферах науки и производства, но и является сильнодействующим ядом. Так, вдыхание паров фенола в течение непродолжительного времени может привести к раздражению носоглотки, ожогам дыхательных путей и последующему отеку легких с летальным исходом.
При соприкосновении раствора фенола с кожей образуются химические ожоги, которые впоследствии трансформируются в язвы. Если обработать раствором более 25 процентов кожных покровов, то это может стать причиной смерти человека.
Попадание фенола внутрь организма с питьевой водой, приводит к развитию язвенной болезни, атрофии мышц, нарушению координации движений, кровотечениям.
Кроме этого, ученые установили, что именно фенол является причиной возникновения раковых заболеваний, способствует развитию сердечной недостаточности и бесплодия.
Благодаря свойству окисления, пары этого химического вещества полностью растворяются в воздухе примерно через 20-25 часов. При попадании в почву фенол сохраняет свои ядовитые свойства на протяжении суток. Однако в воде его жизнеспособность может достигать 7-12 дней. Поэтому наиболее вероятный путь попадания этого ядовитого вещества в человеческий организм и на кожные покровы – загрязненная вода. (2, с.89)
1.1.2 Государственный природный заказник «Воробьёвы горы»
Особо охраняемая природная территория города Москвы природный заказник «Воробьевы горы» образован в целях сохранения, восстановления и развития природного комплекса Москвы постановлением Правительства Москвы от 21 июля 1998 г. № 564 «О мерах по развитию территорий Природного комплекса Москвы».
Задачи природного заказника:
· Сохранение историко-культурных и природных комплексов;
· Сохранение и восстановление ценных объектов и территорий, являющихся местообитаниями редких, находящихся под угрозой исчезновения или уязвимых в условиях города Москвы видов растений, животных, птиц или насекомых;
· Выполнение научно-исследовательских работ по изучению объектов особой охраны природного заказника «Воробьевы горы»;
· Создание условий для поддержания рекреационного потенциала территорий в пределах города;
· Восстановление нарушенных ландшафтов, биогеоценозов, природных, историко-культурных комплексов и объектов.
Территория природного заказника располагается в двух административных округах города Москвы - Западном и Юго-Западном. Общая площадь территории - 137,5 га.
Воробьевы горы – один из семи легендарных московских холмов, на которых стоит наш древний город. Высокий и крутой склон речной долины рассечен глубокими балками, спускающимися к самой Москве-реке. Почти на всем протяжении Воробьевы горы покрывает старый широколиственный лес. Корни мощных деревьев надежно закрепляют крутые склоны от размывания и эрозии. Под пологом леса в числе других травянистых растений встречаются ландыши, колокольчики, медуница. (4)
1.2 Теоретические основы фотоэлектроколориметрического метода анализа
Фотоэлектроколориметрический метод анализа — метод количественного анализа, основанный на зависимости светопоглощения раствора от его концентрации.
Использование света видимой области спектра в данном методе дает возможность анализировать окрашенные вещества или вещества, которые можно перевести в окрашенные растворы.
В основе фотоэлектроколориметрического метода анализа лежит закон Бугера – Ламберта – Бера: абсорбционность прямо пропорциональна концентрации раствора и толщине поглощающего слоя.
А = Е * L* С
Где:
А - абсорбционность,
Е - молярный коэффициент поглощения (абсорбционности)
L - толщина поглощающего слоя,
С - концентрация раствора.
Абсорбционность – отношение интенсивности входящего светового потока к интенсивности выходящего светового потока
Абсорбционность – величина безразмерная и зависит от: 1) природы вещества 2)концентрации анализируемого вещества 3) длины волны падающего светового потока 4) толщины кюветы 5) температуры
Фотоэлектроколориметрический метод относится к объективным методам, так как интенсивность окраски растворов оценивают с помощью специальных устройств – фотоэлементов, в основе устройства которых лежит явление фотоэффекта.
Фотоэффектом называют явление отрыва электронов от атомов веществ под влиянием светового потока.
Фотоэффект бывает внешний и внутренний.
Если электроны отрываются от поверхности тела, то фотоэффект называют внешним.
Если электроны перемещаются во внутренних слоях тела, фотоэффект называют внутренним или объемным.
Устройство, в котором световая энергия преобразуется в электрическую, называют фотоэлементом.
Сущность метода определения
Летучие фенолы, кроме n-крезола и других фенолов, замещенных в n-положении реагируют с 4-аминоантипирином при pH = 10 в присутствии гексацианоферрата (III) калия с образованием красных антипириновых красителей.
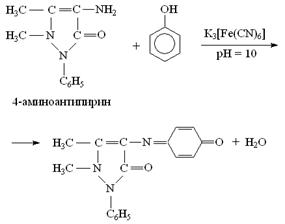
Рис
Определению мешают:
Окислители (Cl2, NaClO), их устраняют добавлением солей Fe2+;
H2S, CN - устраняют перегонкой в присутствии CuSO4.
Необходимо строго поддерживать pH = 10. Добавление NH4Cl к смеси препятствует понижению pH после добавления реактивов.
Если pH > 10,2, то наблюдается значительное колебание интенсивности окраски. При более низких и более высоких значениях pH (кетоны, анилин, другие вещества) также образуют окраску с 4-аминоантипирином.
1.3 Отбор проб и подготовка их к анализу
1.3.1 Отбор проб
Процедура отбора проб воды регламентируется требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб» и др.
Проба воды должна быть представительной (репрезентативной), т.е. должна в максимальной степени характеризовать качество воды по данному показателю, являться типичной и не искаженной вследствие концентрационных и других факторов. Различные виды водоемов (водоисточников) обуславливают некоторые особенности отбора проб в каждом случае.
При отборе проб воды можно решать две задачи: получить характеристику водоема (водотока) или получить характеристику источника загрязнения и оценить его влияние на окружающую среду.
Если решается первая задача, то не рекомендуется отбирать пробы:
в местах, подверженных влиянию притоков( для водотоков) и устьевых районах (для водоемов);
вблизи мест с активной антропогенной деятельностью (вблизи населенных пунктов, предприятий, пристаней);
в местах слабого водообмена, заливах, заводях, зарослях макрофитов, в затонах, на мелководье.
Если решается вторая задача, то, напротив, следует стремиться к отбору проб вблизи источника загрязнения или в нем самом.
Пробы из рек и водных потоков отбирают для определения качества воды в бассейне реки, пригодности воды для пищевого использования, орошения, для водопоя скота, рыборазведения, купания и водного спорта, установления источников загрязнения.
Для определения влияния места сброса сточных вод и вод притоков, пробы отбирают выше по течению и точке, где произошло полное смешение вод. Следует иметь в виду, что загрязнения могут быть неравномерно распространены по потоку реки, поэтому обычно пробы отбирают в местах максимально бурного течения, где потоки хорошо перемешиваются. Пробоотборники помещают вниз по течению потока, располагая на нужной глубине.
При централизованном водоснабжении в населенном пункте пробы воды из водоема можно брать в точке водозабора по глубине и по ширине реки. Для характеристики источника централизованного водоснабжения при существующем водозаборе допускается отбор и первичная оценка проб непосредственно после насосов первого подъема.
Пробы из природных и искусственных озер (прудов). Учитывая длительность существования озер, на первый план выступает мониторинг качества воды в течение длительного периода времени – нескольких лет, а также установление последствий антропогенных загрязнений воды (мониторинг ее состава и свойств). Качество воды в водоемах (и водотоках) носит циклический характер, причем наблюдается суточная и сезонная цикличность. По этой причине; ежедневные пробы следует отбирать в одно и тоже время суток, а продолжительность сезонных исследований должны быть не менее 1 года, включая исследования серий проб, отобранных в течение каждого времени года.
Пробы грунтовых вод отбирают для определения пригодности грунтовых вод в качестве источника питьевой воды, а также для технических или сельскохозяйственных целей; для определения влияния на качество грунтовых вод потенциально опасных хозяйственных объектов; при проведении мониторинга загрязнителей грунтовых вод.
Грунтовые воды изучают, отбирая пробы из артезианских скважин, колодцев, родников. Следует иметь в виду, что качество воды в различных водоносных горизонтах может значительно различаться, поэтому при отборе пробы грунтовых вод следует оценить доступными способами глубину горизонта, из которого отобрана проба, возможные градиенты подземных потоков, информацию о составе подземных пород, через которые пролегает горизонт. Поскольку в точке отбора пробы могут создаться концентрации различных примесей, отличные от их концентраций в водоносном слое, необходимо откачивать из скважины (или из родника, делая в нем углубление) воду в количестве, достаточном для обновления воды в скважине, водопроводе, углублении и т.п.
Пробы воды uз водопроводных сетей отбирают в целях определения общего уровня качества водопроводной воды, поиска причин загрязнения распределительной системы, контроля степени возможного загрязнения питьевой воды продуктами коррозии и др.
Для получения репрезентативных проб при отборе проб воды из водопроводных сетей соблюдают следующие правила:
отбор проб проводят после спуска воды в течение 10-15 мин — времени, обычно достаточного для обновления воды с накопившимися загрязнителями;
для отбора не используют концевые участки водопроводных сетей, а также участки с трубами малого диаметра (менее 1,2 см);
для отбора используют, по возможности, участки с турбулентным потоком – краны вблизи клапанов, изгибов;
при отборе проб вода должна медленно течь в пробоотборную емкость до ее переполнения.
Пробы сточных вод. Место выбора проб сточных вод оценивается и выбирается только после подробного ознакомления с технологией производства, потреблением и сбросом воды, местоположением цехов объекта, системой его канализации, назначением и работой отдельных элементов систем очистки.
При отборе проб следует обращать внимание (фиксировать в протоколе) на сопровождавшие отбор проб гидрологические и климатические условия, такие как осадки и их обилие, паводки, застойность водоема и др.
Посуда для отбора проб должна быть чистой. Сосуды, предназначенные для отбора проб, предварительно тщательно моют, ополаскивают не менее трех раз отбираемой водой и закупоривают стеклянными или пластмассовыми пробками, прокипяченными в дистиллированной воде. Между пробкой и отобранной пробой в сосуде оставляют воздух объемом 5-10 мл. В общую посуду отбирают пробу на анализ только тех компонентов, которые имеют одинаковые условия консервации и хранения.
Оборудование для отбора проб воды
Пробу воды с намеченной глубины открытого водоема выбирают батометром. Допускается отбор проб бутылью. Бутыль закрывают пробкой, к которой прикреплен шнур. Бутыль вставляют в тяжелую оправу или к ней подвешивают груз на тросе (шнур, веревка), в этом случае к горлу бутыли привязывают трос.
Перед отбором пробы бутыль не менее двух раз ополаскивают водой, подлежащей исследованию.
Бутыль опускают на намеченную глубину, пробку вынимают при помощи троса. После того как вода заполнит бутыль, ее вынимают при помощи шнура. Пробу воды с небольшой глубины (особенно зимой) отбирают шестом с прикрепленной к нему бутылью. Затем бутыль герметично закрывают. В бутыли оставляют воздух (исключение составляют некоторые анализы, например определение рН).
Пробы воды из скважин отбирают насосом или глубинным пробоотборником с узким сечением. (3,с. 50)
2. Экспериментальная часть
2.1 Приборы, реактивы, материалы, посуда
Для проведения анализа были использованы:
2.1.1 Приборы
· КФК-2
· Аналитические весы
2.1.2 Реактивы
· Аммиак конц. 25%
· Х.ч. хлористый аммоний
· Х.ч. 4-аминоантипирин
· Х.ч. Гексацианоферрат калия
· Фенол
2.1.3 Материалы
· Проба воды
2.1.4 Посуда
· Мерные колбы 1000мл, 500мл, 250мл.
· Склянки 100мл
· Пипетки
· Бюретка
· Стакан 100 мл
2.2 Приготовление растворов
2.2.1 Приготовление аммиачно-буферного раствора
20 г хлористого аммония(х.ч.) взвешивают на технических весах, переносят навеску в колбу, добавляют 100 мл концентрированного раствора аммиака (х.ч., 25 %) и разбавляют до 1 л дистиллированной водой, закрывают пробкой, перемешивают.
2.2.2 Приготовления раствора 4-аминоантипирина
2 г х.ч. аминоантипирин взвешивают на технических весах, переносят в склянку на 100 мл и объём в склянке доводят дистиллированной водой до метки, закрывают пробкой, перемешивают.
2.2.3 Приготовления раствора гексацианоферрата(III) калия
4 г х.ч. Гексацианоферрат(III) калия (х.ч.)на технических весах, количественно переносят в склянку на 100 мл и объём в склянке доводят дистиллированной водой до метки, закрывают пробкой, перемешивают.
2.2.4 Приготовление основного раствора
ЗАДАЧА. Сколько граммов фенола необходимо взять для приготовления 1 литра раствора с массовой концентрацией фенола 1,00 г/л.
Дано:
Cm (C6H5OH) = 1,00 г/л
Vм.к. = 1000,00 мл
![]()
Вычислить массу навески mн - ?
mн = 1,0000 г
Методика приготовления раствора
1,0000 г фенола взвешивают на аналитических весах, количественно переносят в мерную колбу 1 литр, растворяют, объем в мерной колбе доводят дистиллированной водой до метки, закрывают пробкой, перемешивают.
2.2.5 Приготовление рабочего раствора
ЗАДАЧА. В мерной колбе 500 мл приготовить рабочий раствор с массовой концентрацией фенола 10,00 мкг/мл из основного раствора с массовой концентрацией фенола 1,00 г/л.
Дано:
Cm (C6H5OH)1 = 1,00 г/л
Cm (C6H5OH)2 = 10,00 мкг/мл (мг/л)= 0,0100 г/л
Vм.к. = 500,00 мл
![]()
Вычислить объем основного раствора?
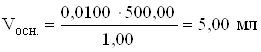
Методика приготовления рабочего раствора
5,00 мл основного раствора отмеривают пипеткой, переносят в мерную колбу 500 мл, разбавляют дистиллированной водой до метки, закрывают пробкой, перемешивают.
Раствор готовят в день выполнения анализа. Раствор устойчив 1 день.
2.2.6 Приготовление серии градуировочных растворов
В мерные колбы 250,00 мл по бюретке отмеривают рабочий раствор:
0 мл; 5,00 мл; 10,00 мл; 20,00 мл; 30,00 мл; 40,00 мл; 50,00 мл.
В каждую мерную колбу добавляют дистиллированную воду до метки, затем с помощью пипеток добавляют 1 мл аммонийно-буферной смеси (pH=10), 2 мл 4-аминоантипирина, перемешивают и добавляют 2 мл гексацианоферрата (III) калия. Мерные колбы закрывают пробками и перемешивают.
Вычисления концентрации приготовленных растворов:
![]()
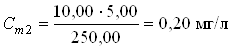
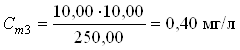
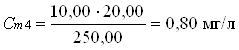
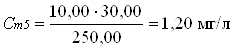
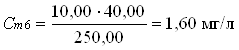
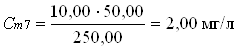
2.3 Отбор проб и подготовка пробы к анализу
Отбор проб подробно описан в пункте 1.3.
250,00 мл анализируемой воды отмеривают мерной колбой, затем с помощью пипеток добавляют 1 мл аммонийно–буферной смеси (pH=10), 2 мл 4-аминоантипирина, перемешивают и добавляют 2 мл гексацианоферрата (III) калия. Мерную колбу закрывают пробкой и смесь вновь перемешивают.
2.4 Схема и принцип действия прибора
Определение содержания фенолов в воде проводится на приборе КФК-2
Однолучевой фотометр КФК-2 предназначен для измерения пропускания, оптической плотности и концентрации окрашенных растворов и коллоидных растворов в области спектра 315-980 нм.

Рис.2.1. Колориметр КФК - 2
Техническое описание колориметра КФК-2Колориметр КФК-2 предназначен для измерения в отдельных участках диапазона длин волн 315-980 нм, выделяемых светофильтрами, коэффициентов пропускания и оптической плотности жидкостных растворов и твердых тел, а также определения концентрации веществ в растворах методом построения градуировочных графиков.
2.5 Методика проведения анализа
2.5.1 Выбор условий определения
Условия определения выбирают через 15 минут.
а) Выбор светофильтра. Для практического выбора светофильтра берут стандартный раствор максимальной концентрации. Измеряют абсорбционность (А) этого раствора на всех светофильтрах по отношению к холостому раствору. По полученным данным строят график в координатах: абсорбционность (А) – длина волны падающего света (λ).(см.рис.2.3.)
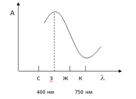
Рис.2.2. Зависимость абсорбционности от длины волны
Выбирают для анализа тот светофильтр, который дает максимальное значение абсорционности (А). В данном случае - зеленый светофильтр.
б) Выбор кюветы. Для выбора кюветы (толщины поглощающего слоя) берут стандартный раствор максимальной концентрации. Измеряют абсорбционность (А) на выбранном светофильтре во всех кюветах по отношению к холостому раствору. Абсорбционность должна быть близкой к единице.
2.5.2 Построение градуировочного графика
Измеряют абсорбционность (А) на выбранном светофильтре и в выбранной кювете всех стандартных растворов по отношению к холостому раствору. Строят график в координатах абсорбционность (А) – концентрация (С). (см.рис. 2.4.)
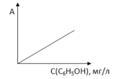
Рис.2.3. Зависимость абсорбционности от концентрации
2.5.3 Определение концентрации фенола в воде
Измеряют абсорбционность (А) анализируемой воды по отношению к холостому раствору и по градуировочному графику находят концентрацию фенола в мг/л.
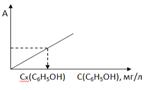
Рис. 2.4. Иллюстрация графического способа определения концентрации фенола
2.6 Графики, расчёты, таблицы
2.6.1 Выбор светофильтра
Таблица 2.2. Выбор светофильтра
| Λ, нм | А |
| 400 | 0,70 |
| 440 | 0,45 |
| 490 | 0,30 |
| 540 | 0,10 |
| 590 | 0 |
| 670 | 0,025 |
| 750 | 0,023 |

Рис.2.3. График выбора светофильтра
Светофильтр выбираем тот, который даёт максимальное значение абсорбционности. По графику видно, что дальнейшие измерения будем проводить на длине волны 400 нм.
2.6.2 Построение градуировочного графика
Таблица 2.2. Построение градуировочного графика
| С, мг/л | А |
| 0 | 0 |
| 0,20 | 0,13 |
| 0,40 | 0,25 |
| 0,80 | 0,27 |
| 1,20 | 0,30 |
| 1,60 | 0,38 |
| 2,00 | 0,40 |
| Контрольная проба | 0,65 |

Рис. 2.7.Градуировочный график для определения концентрации фенола в воде.
A = 0, 238 * C
С = А / = 0,238
С = 0,65 / 0,238 = 2,73 мг/л
3. Безопасность жизнедеятельности.
3.1 Техника безопасности в химической лаборатории
1. К работе допускаются лица, прошедшие инструктаж по технике безопасности
2. Нельзя приступать к работе без разрешения преподавателя
3. Не оставлять действующие приборы без присмотра
4. Во время работы соблюдайте тишину, порядок, чистоту.
5. Во время работы необходимо одевать халат
6. Нельзя производить работы в загрязненной посуде
7. Посуду следует мыть сразу после окончания работы
8. Не выносить посуду, приборы, реактивы из лаборатории
9. Работать с токсичными веществами нужно в вытяжном шкафу
10. Необходимо строго соблюдать меры предосторожности при работе с взрывоопасными и легковоспламеняющимися веществами
11. Нельзя выливать в раковину остатки химических реактивов
12. При взвешивании сухих реактивов не высыпать прямо на чашку весов
13. Запрещено принимать пищу в лаборатории
14.Нельзя пробовать на вкус любые вещества и их растворы
15. Нюхать вещества можно лишь осторожно направляя к себе их пары
16. Студент должен знать где находятся средства противопожарной защиты, а также аптечка
17. Работы с высокоопасными веществами следует проводить под наблюдением преподавателя или лаборанта
18. При обращении с концентрированными кислотами и щелочами необходимо наливать их только через во
