Визначення сполук купруму в довкіллі
Визначення сполук Купруму вдовкіллі
Зміст
Вступ
1. Характеристика шляхів надходження в довкілля сполук Купруму
2. Форми знаходження сполук Купруму в об'єктах навколишнього середовища
3. Огляд та характеристика методів визначення сполук Купруму в об'єктах навколишнього середовища
3.1 Визначення Купруму гравіметричними методами
3.2 Визначення Купруму титриметричними методами
3.3 Визначення Купруму фотометричними методами
3.4 Визначення Купруму люмінесцентним та полярографічним методами
3.5 Визначення Купруму методами спектроскопії
4. Екстракційно-фотометричне визначення Купруму в природній воді
4.1 Приготування розчинів
4.2 Проведення аналізу
4.3 Обробка результатів
Висновок
Список використаної літератури
Вступ
Вода є джерелом фотосинтезу і кисню, найважливішим розчинником неживої природи та продукції промислового і сільськогосподарського виробництва. Врешті - решт сама людина більше, ніж наполовину, складається з води. Певно, саме тому Арістотель вважав воду одним із головних елементів світобудови. І з ним важко не погодитись, адже немає іншого природного тіла, яке могло б зрівнятися за впливом на перебіг основних, найграндіозніших геологічних процесів. Разом із тим вона є найбільш вразливим компонентом навколишнього середовища. З розвитком хімічної, нафтохімічної, гірничорудної, целюлозно - паперової промисловості та комунікацій склад води швидко погіршується.
До водних об’єктів, які потребують екологічного вивчення, належать океани, моря, річки, озера, штучні водойми, болота, підземні та стічні води. Основними забруднювачами річок та водосховищ є: пестициди, сполуки нітрогену і фосфору, важкі метали, радіонукліди, нафтопродукти. (1)
Грунт - основа біосфери. В ньому накопичуються і зберігаються в легкодоступній формі елементи, які необхідні для підтримки та відтворювання життя. Мікроелементи, що знаходяться в грунтах, грають велику роль в активації ферментів в рослинному організмі. Купрум - це пластоцианіна (особливий білок), який міститься в хлоропластах і необхіден для фотосинтезу. Недоліку міді можна позбутися, якщо внести в грунт мідний купорос. Багато мікроелементів (серед яких і Купрум) підвищують швидкість окисно-відновних процесів, і зокрема, дихання, в рослинах, які беруть участь в утворенні органічних кислот і інших речовин, необхідних для синтезу білка, клітчатки, лігніна та ін. Купрум позитивно впливає на утворення хлорофілу в листках і зменшує розпад його в темряві; дуже добрий для фотосинтезу в умовах високої температури і недостачі вологи у рослин; здатний прискорювати розвиток рослин і дозрівання насіння. Відзначено позитивний вплив міді на стійкість рослин до недостачі вологи в грунті, поганим умовам перезимовки, пониженій або підвищеній температурі і засоленню грунтів. Мікроелементи відіграють важливу роль у боротьбі з деякими грибними і бактеріальними хворобами рослин.
Купрум застосовується для виготовлення кабелів, струмопровідних частин електричних установок, теплообмінників. Він є основним компонентом латуней, бронзи, мідно-нікелевих та інших сплавів, які володіють високими антифрикційними властивостями та поєднуються з гарною корозійною стійкістю на повітрі. Ці сплави характеризуються, крім того, гарною електропровідністю, пластичністю і достатньо високою міцністю.
1. Характеристика шляхів надходження в довкілля сполук Купруму
Мікроелементи представляють найбільшу за чисельністю групу в складі природних вод. Її складають всі елементи періодичної системи. Мікроелементи умовно ділять на декілька підгруп, мідь відноситься відповідно до іонів важких металів.
В теперішній час стає все більш очевидним, що нема ні одного якого-небудь важливого біохімічного процесу, ні однієї фізіологічної функції, які виконуються без участі того чи іншого мікроелементу. Зростаючий інтерес до мікроелементів природніх вод обумовлений насамперед виявом їх важливої фізіологічної ролі в життєдіяльності гідробіонтів.
Концентрація сполук Купруму в природних водах знаходиться в межах від 1,0 до 30,0 мікрограмів на 1 л. Мідь є одним із найбільш розповсюджених мікроелементів. Шляхи надходження в природні води можна розділити на дві великі групи: надходження ззовні та накопичення за рахунок внутрішньоводоймних процесів. Зовнішні джерела - надходження біогенних речовин в водойми з річковим стоком, атмосферними опадами, промисловими, господарсько-побутовими і сільськогосподарськими стічними водами. Особливе місце займає виробнича діяльність людини.
Слід зазначити, що в останні роки в багатьох країнах світу антропогенний фактор в формуванні хімічного складу природних вод стає домінуючим і тенденція забруднення їх важкими металами значно підвищується. (2)
Джерела надходження Купруму в грунт: відкритий видобуток корисних копалин; викиди металургійних заводів, хімічних підприємств, сміттєспалювальних фабрик; ТЕС; звалища відходів; атмосферні опади; пожежі тощо. Метали поріявняно легко накопичуються в грунтах, але повільно і важко видаляються з них. Так, період напіввидалення Купруму - до 1500 років. Середня масова частка Купруму у грунті: 2-100 мг/кг.
Поблизу гірничо-металургійних комбінатів у радіусі 5 км спостерігається висока забрудненість грунтів важкими металами, в радіусі 20-50 км - менша. Іноді виникають "технологічні пустелі", позбавлені гумусу й рослинності, значною міроюб еродовані. Навколо великих ТЕС забруднення відбувається в радійсі 10-20 км. Важкі метали вимиваються із відвалів зол і шлаків ТЕС.
Важкі метали в грунті можуть:
- утворювати малорухливі форми у вигляді малорозчинних сполук;
- зв'язуватися в стійкі розчинні комплекси з численними органічними лігандами, зокрема гуміновими та фульвіновими кислотами;
- мігрувати у вигляді розчинних сполук;
- накопичуватися в рослинах і передаватися по ланцюгах живлення;
- поглинатися грунтовим вбирним комплексом;
- потрапляти в організм грунтових мешканців.
Купрум зумовлює: зниження активності ферментів, взаємодію з клітинними мембранами і зміну їх проникності та інших властивостей. (3)
2. Форми знаходження сполук купруму в об'єктах навколишнього середовища
Вміст Купруму в земній корі складає близько 0,01%. Він зустрічається в вільному стані у вигляді самородків, що досягають значних розмірів (до декількох тон).
Однак руди самородного Купруму порівняно мало розповсюджені, в наш час з них добувається не більше 5 % Купруму від загального її світового добування. Купрум є халькофільним елементом, він присутній в земній корі в вигляді сполук з сіркою в складі до 80 %. Біля 15 % Купруму знаходиться в вигляді карбонатів, силікатів, оксидів і т.п., що є продуктами вивітрювання первинних сульфідних мідних руд.
Купрум утворює до 240 мінералів, однак лише 40 мають промислове значення.
Розрізняють сульфідні та окислені руди міді. Промислове значення мають сульфідні руди, з яких найбільш широко використовується мідний колчедан (халькопірит) CuFeS2.
В природа він зустрічається головним чином в суміші з залізним колчеданом FeS2 і порожньою породою, що складається з оксидів Si, Al, Ca та ін.
Часто сульфідні руди містять домішки благородних металів (Au, Ag), кольорових і рідкісних металів (Zn, Pb, Ni, Co, Mo та ін.) та розсіяних елементів (Ge та ін.).
Вміст Купруму в руді звичайно складає 1 - 5 %, але завдяки тому, що халькопірит легко флотується, його можна збагачувати, отримуючи концентрат, що містить 20 % міді та більше.
Найбільші запаси мідних руд зосереджені на Уралі, в Казахстані та Середній Азії, а також в Африці (Катанта, Замбія), Америці (Чілі, США, Канада).
В природних водах Купрум може міститися як у вигляді гідратованого іону, так і в вигляді його комплексів з неорганічними та органічними лігандами; іони можуть бути адсорбовані неорганічними або органічними колоїдами. Іони важких металів в водах подавляють життєдіяльність простих організмів, тому в показниках якості питних і промислових вод наведені найвищі ГДК для цих іонів.
Для міді ГДК складає 0,05 - 0,1 мг/л, і тільки в особливих випадках в питних або поверхневих водах допускається короткочасне підвищення концентрації міді до 1,0 мг/л. (4)
3. Огляд та характеристика методів визначення сполук Купруму в об'єктах навколишнього середовища
3.1 Визначення Купруму гравіметричними методами
З гравіметричних методів визначення Купруму найбільш точним є електролітичний, однак його застосування обмежується необхідністю відділення заважаючих іонів. Електролітичний метод отримав широке застосування в практиці заводських лабораторій при визначенні міді.
Гравіметричне визначення Купруму проводять шляхом електролітичного виділення її у вигляді металу на платиновому, ртутному, нікелевому або латунному катодах різних конструкцій. В якості електроліту використовують азотну, сірчану, хлоридну, фосфорну кислоти, їх суміші.
Більш повне осадження Купруму в вигляді жовтувато-червоного осаду досягається при електролізі сірчанокислих розчинів, які містять невеликі кількості азотної кислоти.
Визначення Купруму в присутності заліза проводять шляхом електролізу азотнокислого розчину або сірчанокислого розчину, що містить надлишок ЕДТА. З цією метою також використовують вібруючий катод і пористу фарфорову діафрагму, що розділяє анодний і катодний простір. Метод дозволяє визначити до 0,1 г міді в присутності 20-кратної кількості заліза (Fe(ІІІ) попередньо відновлюють) з похибкою 0,1%. Тривалість електролізу 10 хвилин.
Точне та швидке визначення Купруму в присутності великих кількостей олова, свинцю та алюмінію проводять шляхом електролітичного осадження її з фосфорнокислих розчинів. Метод рекомендується для аналізу латуні, бронзи, сплавів на олов’яній та алюмінієвій основах. (4)
Гравіметричний аналіз - метод хімічного аналізу, який ґрунтується на точному вимірюванні маси визначуваної речовини або її складових частин, які виділяються в хімічно чистому стані або у вигляді відповідних сполук. Гравіметрія - це абсолютний метод.
Для визначення маси речовини в якісному аналізі гравіметричного методу використовують аналітичні терези. Вони дозволяють визначати масу із точністю до 0,0001 г. Наважки твердих речовин звичайно беруть в бюксах. Бюкси обов’язково використовують також при зважуванні гігроскопічних та летких речовин.
Важливим інструментом в гравіметрії є скляні палички, які використовуються для перемішування розчинів, для фільтрування рідин, перенесення їх із однієї посудини в іншу. Ці палички діаметром 4 - 6 мм.
Гравіметричні методи аналізу дозволяють з відносно великою точністю визначати кількісний вміст компонентів або (якщо це розчин) концентрацію речовин в пробі, що аналізується. Гравіметричний аналіз використовується для визначення дуже великої кількості металів (катіонів) та неметалів (аніонів), складових частин сплавів, руд, силікатів, органічних сполук та ін. Гравіметричні методи широко використовуються при виконанні науково - дослідних робіт для порівняння аналітичних даних, отриманих різними методами. Це пов’язано з тим, що гравіметричні методи ніколи не змінюють свого значення.
Найбільш суттєвою перевагою гравіметричного аналізу є висока точність аналізу. Звичайна похибка гравіметричного визначення складає 0,1...0,2%. (5) До числа переваг гравіметричного методу також можна віднести відсутність будь-яких стандартизацій або градуювок за стандартними зразками, необхідними майже в будь-якому іншому аналітичному методі. Для розрахунку результатів гравіметричного аналізу потрібно знання лише молярних мас і стехіометричних співвідношень.
Селективність гравіметричного аналізу невисока в зв’язку з відсутністю відповідних реагентів на більшість іонів. Суттєвим недоліком гравіметричного методу є тривалість визначення. (6)
3.2 Визначення Купруму титриметричними методами
Найбільше розповсюдження з титриметричних методів визначення Купруму отримали комплекснометричний і йодометричний. Методи осадження, що базуються на утворенні важкорозчинних осадів, в основному з сірковмісними органічними сполуками, закінчують, як правило, елекрохімічно.
Алкаліметричне визначення Купруму з використанням крезолфталеїну для встановлення кінця титрування відрізняється швидкістю, але невисокою точністю.
Пряме титрування солей Купруму можливе солями металів в нижчих степенях окислення.
Потенціометричне титрування Сu (ІІ) розчином Fe (II) з Pt-електродом проводять в 14 М H3PO4.
Броматометричний метод пропонує виділення міді дитизоном, ο-оксихіноліном або резацетофеноном, розчинення осаду та титрування бромат-бромідним розчином в присутності метилового оранжевого. Розроблений варіант броматометричного визначення міді з попереднім виділенням її дифенилтіовіолуровою кислотою. Похибка визначення 20-30 мг міді складає 0,03-0,08%.
Виділення міді (ІІ) в осад проводять як неорганічними, так і органічними (в основному сірковмісними) осаджувачами. (4)
Титриметричний метод аналізу - метод кількісного аналізу, який ґрунтується на вимірюванні кількості реагента, необхідного для завершення реакції з певною кількістю визначуваної речовини. Метод полягає в тому, що до розчину визначуваної речовини поступово додають розчин реактива відомої концентрації. Додавання реактиву відбувається до тих пір, поки його кількість не стане еквівалентна кількості визначуваної речовини.
Титриметричні методи аналізу ґрунтуються на використанні самих різноманітних реакцій: нейтралізації, окислення - відновлення, осадження, комплексоутворення.
За способом виконання розрізняють пряме титрування, зворотне титрування та титрування замісника.
Для проведення хімічного аналізу титриметричним методом крім звичайного хімічного посуду широко використовують мірний посуд, який служить для точного вимірювання об’ємів розчинів. До нього відносять: мірні колби, піпетки, бюретки.
Чим відповідальніше проводять дані вимірювання, тим точніші результати аналізу. (5)
4.3 Визначення Купруму фотометричними методами
Мідь утворює забарвлені сполуки з великим числом органічних сполук різних класів.
Найбільш широко застосованим і доступним реагентом є діетилдитіокарбамат натрію. В присутності комплексоутворювачів реагент достатньо селективний і чутливий. Набагато більшою вибірковістю володіють диетилдитіокарбамати кадмію, свинцю і цинку. (4)
Екстракційно-фотометричне визначення з діетилдитіокарбаматом свинцю.
Іони Купруму реагують з діетилдитіокарбамінатом свинцю у хлороформі з утворенням нерозчинної у воді комплексної сполуки:
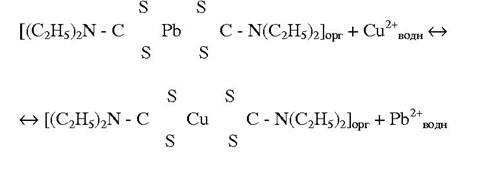
При 430 нм зберігається лінійна залежність між вмістом Купруму і оптичною густиною неводного розчину в інтервалі концентрацій 0,5 - 10 мкг. Чутливість методу становить 2 мкг Cu/л.
Визначенню Купруму заважає понад 30 мкг/л вісмуту, а також іони срібла та ртуті. Іони вісмуту також утворюють розчинний у хлороформі комплекс жовтого кольору, а срібло та ртуть - безбарвні комплекси. Комплексні ціаніди повинні бути зруйновані випарюванням проби з 0,5 мл розбавленої (1:1) сірчаної кислоти і 5 мл концентрованої азотної кислоти. Проби з високим вмістом органічних сполук мінералізують за допомогою персульфату. (7)
Специфічним реагентом на мідь є дисульфід меркаптохіноліну. Найбільш чутливим (але не селективним) є дитизон. На відміну від інших реагентів його можна застосовувати в кислих розчинах. Похідні 1,10-фенантроліну менш чутливі, ніж ДДТК-Na. Визначенню міді з використанням цих реагентів заважають аніони-комплексоутворювачі. 2,2΄-Дихіноліл і його похідні практично можуть бути застосовані для аналізу будь-яких об’єктів. (4)
Екстракційно-фотометричне визначення з дитизоном.
Іони Купруму екстрагують з води розчином дитизону (2-фенілгідразид тіомурашиної кислоти, синонім - дифенілтіокарбазон ) у чотирихлористому вуглеці. При цьому утворюється забарвлений у червоний колір комплекс дитизонату міді, інтенсивність забарвлення якого пропорційна концентрації міді:

Іони міді кількісно екстрагуються дитизоном в інтервалі рН 4 - 7. (7)
Для аналізу об’єктів, що містять великі кількості міді, часто використовують різні комплексони та аміни.
Все більше значення набувають каталітичні методи визначення міді, що використовують її здатність каталізувати деякі реакції та дозволяють визначати до 10-6% Cu.
Високою чутливістю і достатньою селективністю володіє фотометричний метод з використанням дикупралю, який дозволяє визначити 0,05 - 0,1 мг/л міді в мутних і кольорових водах. Методи з використанням дитизону і його похідних володіють високою чутливістю, але маловибіркові. Тому дитизон використовують, як правило, для концентрування міді з природних вод. Визначення закінчують використанням інших органічних реагаентів або спектральним методом.
Фотометричнй метод ґрунтується на вимірюванні поглинання світла, що падає на речовину (зразок). Його частіше усього вимірюють шляхом зрівняння інтенсивності світла зовнішнього джерела, що падає на зразок та інтенсивності світла, що пройшла через зразок. При вимірюванні інтенсивності світла може відбуватися не тільки світлопоглинання, а також відбивання та розсіювання. Щоб цього уникнути розчин, що фотометрують повинен бути прозорим.
Розрізняють два важливих закони світлопоглинання: закон Бугера – Ламберта – Бера та закон адитивності.
Закон Бугера – Ламберта – Бера виражає залежність між зменшенням інтенсивності, що пройшла через шар світлопоглинаючої речовини, концентрацією речовини та товщиною шару. І має таку загальну формулу (1):
А = Е l С, (1)
де А - оптична густина;
С - концентрація частинок, що поглинають;
l - товщина шару розчину, який містить частинки, що поглинають.
Згідно закону адитивності, оптична густина суміші речовин, які підпорядковуються закону Бугера - Ламберта - Бера та не взаємодіють між собою, дорівнює сумі оптичних густин, які відповідають поглинанню кожної речовини, основою є формула (2):
А = Е1 l c1 + Е2 l c2 + ... (2)
В фотометрії для реєстрації спектроскопічних сигналів використовують такі основні вузли: джерело світла, монохроматизатор світла, кювети, пристрій для визначення інтенсивності світла.
Для вимірювання в видимій частині спектру використовують кювети із скла. А для вимірювання в ультрафіолетовій частині спектру використовують кювети із кварцу. (8)
Фотометричний метод відноситься до середньо чутливих методів; нижня межа визначуваної концентрації min = 10-7М; верхня межа визначуваної концентрації max = 10-2М; відносна похибка 3 - 5%; селективність невисока.
3.4 Визначення Купруму люмінесцентним та полярографічним методами
Люмінесцентний аналіз грунтується на здатності речовин випромінювати світло під дією різних збудників, наприклад, енергії хімічної реакції (хемілюмінесценсія). Люмінесцентним методом аналізують природні і стічні води, грунт (Купрум визначають в межі 0,05 мг/л ). Похибка методу 5..7%. (6)
Полярографічний метод аналізу дає можливість визначити мідь при концентрації її в розчині 1,0-1,0-4г/л, а при використанні особливих прийомів роботи чутливість його може бути підвищена до 1,0•10-5 - 5,0•10-9г/л.
Найбільш часто для визначення Купруму використовують краплинний ртутний електрод, на якому іони міді (ІІ) відновлюються. Мідь утворює з ртуттю ряд сполук від Cu7Hg до СuHg4, що використовується в методі зі стаціонарною краплею ртуті для визначення 10-7 - 10-8 М міді. Характер процесу відновлення в значній степені визначається складом електроліту. В розчинах нейтральних електролітів, які не утворюють комплексів з іонами двохвалентної міді (наприклад, в сульфатних і нітратних), процес відновлення іонів Cu (II) до Cu(0) протікає в одну стадію і виходить тільки одна хвиля, з потенціалом півхвилі Е1/2=0,02 В.
При наявності в розчині речовин, здатних утворювати комплекси з іонами Cu (ІІ) (аміакати, амінати, піридинати, комплексонати, тартрати, ацетати, хлоридні, роданідні та інші комплекси міді), процес відновлення іонів Cu (ІІ) протікає в дві стадії. При цьому на полярограмі виходить дві хвилі. Перша хвиля відповідає процесу відновлення Cu (ІІ)до Cu (І), а друга - відновленню Cu (І) до металу.
В якості фону найчастіше застосовують амонійно-аміачний розчин. В цьому випадку на полярограмі виходить дві хвилі, потенціали півхвиль яких залежать від концентрації аміаку і хлориду в розчині та природи утворюючих комплексів.
Метод визначення Купруму в сталях, чавунах та інших матеріалах, що містять залізо, забезпечується полярографуванням на аміачному фоні без попереднього відділення заліза. Для запобігання адсорбції міді осадом гідроксиду заліза (ІІІ) концентрація аміаку в розчині повинна бути не менше 3 М, а концентрація хлориду амонію 0,7 - 1,0 М. Метод визначення Купруму в металічному магнії та його сплавах пов’язаний з попереднім виділенням її з лужного розчину в вигляді дитизонату або диетилдитіокарбамату і наступним полярографуванням на фоні виннокислого, лимоннокислого або аміачного розчину хлориду амонію. (4)
3.5 Визначення Купруму методами спектроскопії
Емісійний спектральний аналіз є одним з найбільш широко застосованих для визначення Купруму фізичних методів. Визначення Купруму може бути проведено різними варіантами цього методу, що відрізняються способом збудження і реєстрації характеристичного випромінювання: емісійним, полум’яно-фотометричним, флуоресцентним, активаційним, рентгеноспектральним та ін.
В аналітичній емісійній спектрометрії найбільш часто використовуються в якості джерел випромінювання гарячі полум’я, електричні дугові або іскрові розряди, рентгенівські промені високої енергії, а також спеціальні джерела: плазмові струмені, розряди в лампі з полим катодом, електроди високих енергій та ін. Для випаровування та збудження атомів твердих тіл ефективними є дугові та іскрові електричні розряди. В ряді випадків зручно застосовувати такі способи збудження, як газові розряди і плазмові факели.
Широко використовується емісійно-спектральний метод для визначення Купруму в чистому алюмінію, алюмінієвих латунях, бронзах, катодному нікелі, нікелевих і цинкових сплавах, ніобії, гафнії, сурьмі і вісмуті. (4)
Чутливість методу залежить від способу атомізації і природи визначуваного елементу. Метод є більш селективний, ніж фотометричний. Діапазон лінійної залежності І від С буде рівним 4 - 5 порядків концентрації.
Для визначення Купруму в твердих і рідких пробах звичайно використовують лінію 324,7 нм. Метод використовується для визначення міді в сплавах, залізомарганцевих конкреціях, сталі, бронзі, морській воді, грунтовій витяжці.
До флуоресцентних відносять метод рентгенівської флуоресценції (збудження характеристичного випромінювання зразка під дією високоенергетичного випромінювання) і метод атомно-флуоресцентної спектрометрії (збудження під дією випромінювання ізольованих атомів металу). Головною перевагою флуоресцентних методів аналізу є їх висока чутливість, яка досягається за рахунок того, що зовнішнє джерело розміщується звичайно під прямим кутом до оптичної осі монохроматору. Крім того, за допомогою атомно-флуоресцентної спектрометрії можна одночасно визначити багато елементів із збудженням їх атомів джерелом суцільного спектру. Спектри флуоресценції достатньо прості.
Рентгенівську спектроскопію застосовують для визначення як низьких (10-11 - 10-12 г), так і високих концентрацій Купруму. Рентгеноспектральний аналіз є емісійним методом. В цьому випадку в аналізованому зразку збуджують первинний характеристичний спектр визначуваного елемента швидкими електронами, за інтенсивністю його аналітичних ліній визначають концентрацію міді та інших елементів.
Метод рентгенівської флуоресценції повного відображення (в варіанті рентгенофлуоресцентного методу з дисперсією за енергією) дозволяє визначити 30 - 240 нг/л міді в дощовій воді.
Визначення міді в пробах, які мають однорідний вміст, проводять за способом “стандарт - фону”. Аналіз проб різного вмісту проводять з використанням в якості внутрішнього стандарту нікелю або цинку.
Рентгеноспектральний метод аналізу використовується в металургійному виробництві, для визначення міді в нержавіючій сталі, латуні, шлаках, гальванічних ваннах.
Пряме спектральне визначення Купруму не завжди відповідає практичним вимогам, тому підвищення чутливості досягається концентруванням сумішей. Найбільш часто використовують попередню екстракцію деякими органічними сполуками (найчастіше використовують ДДТК-Na).
Поряд з хімічними методами збагачення застосовують і фізичні методи, які безпосередньо сполучаються з наступним спектральним аналізом.
Спектральним методом Купрум визначають в сталях, залізних матеріалах (10-4% Cu), білому залізному сирці. При аналізі залізних каталізаторів мідь визначають по лінії 327,3 нм з чутливістю 10-2 - 10-5% Cu (похибка визначення 10 - 40%). (4)
При визначенні Купруму методом атомно-абсорбційної спектроскопії можливе пряме введення проби морської води в атомізатор у вигляді аерозолю, але через неселективне поглинання світла межа визначення міді 0,1 мкг/мл.
Атомно-абсорбційний спектральний аналіз грунтується на визначенні концентрації речовини за поглинанням шаром атомної пари елемента монохроматичного резонансного випромінювання. Широкий розвиток методів атомно-абсорбційної спектрометрії для кількісного визначення Купруму пов’язаний з його можливостями атомізації різними способами, як полум'яними, так і не полум’яними.
Найбільш часто використовують методи полум’яної атомізації, які поряд з простотою забезпечують кращу відтворюваність результатів, ніж електротермічні методи. Як правило, використовують полум’я ацетилен - повітря.
Сполуки Купруму, що утворюються при висиханні крапель аерозолю, термічно нестійкі; вони повністю руйнуються і дисоціюють в полум’ї ацетилен - повітря. З іншої сторони, потенціал іонізації Купруму відносно високий і тому її атоми при температурі полум’я ацетилен - повітря практично не іонізуються. Тому застосування методу атомно-абсорбційної спектрометрії для визначення Купруму досить ефективне.
Атомно-абсорбційним методом визначають мікродоміси міді в напівпровідникових матеріалах, в сплавах на основі цирконію, заліза (0,001 - 0,3% Cu) та в залізних матеріалах, в алюмінії та алюмінієвих сплавах, в металічному вольфрамі, високочистому сріблі. Екстракцією з купфероном визначають Купрум в кадмії (10-5г/г Cu), з батофенантроліном - в урані (1,5·10-4% Cu). Атомно -абсорбційний аналізатор МГА - 915 - спектрометр із земанівською корекцією, застосовують для елементного аналізу природних, питних і стічних вод, грунтів (при об’ємі проби 40 мкл межа визначення купруму - 0,07 мкг/л ).
Забруднення світового океану токсичними антропогенними сумішами викликає необхідність постійного контролю. Після концентрування визначенння проводять методами атомно-абсорбційної спектроскопії, емісійної спектроскопії.
Методом абсолютної потенціометрії вимірюють потенціал Е і за рівнянням Нернста обчислюють концентрацію іона в речовині. Йоноселективні електроди дають змогу встановити вміст купруму. (4)
4. Екстракційно-фотометричне визначення купруму в природній воді
Визначення Купруму базується на утворенні комплексу з діетилдитіокарбаматом жовтого кольору, подальшій його екстракції і фотометруванні органічного шару. Оскільки визначенню заважають інші катіони металів, аналіз проводять при певному рН у присутності цитратної кислоти, яка зв'язує Fe3+, Zn2+, Mn2+ в безбарвні комплекси, що залишаються у водній фазі.
Обладнання: фотоелектроколориметр, кювети з товщиною світлопоглинаючого шару 1 см, аналітичні та електронні терези, ділильна лійка, пробірки з притертою пробкою, піпетки, колби, циліндри, склянка з темного скла, мірний циліндр.
4.1 Приготування розчинів
Розчин діетилдитіокарбамату плюмбуму в CCl4
На аналітичних терезах зважують 0,0486 г Pb(NO3)2 , розчиняють в 10 мл дистильованої води (відібравши певний об'єм мірною піпеткою). Зважують 0,0664 г ДЕТК Na. В ділильну лійку вносять 100 мл CCl4 (вимірявши об'єм мірним циліндром), 0,0664 г ДЕТК Na та 0,0486 г Pb(NO3)2 (попередньо розчиненого в 10 мл води). Отриману суміш в ділильній лійці струшують протягом 5 хвилин. Після чого закріплюють лійку на штатив та дають відстоятися розчину дві хвилини. Нижній органічний шар із розчиненим у ньому ДЕТК Рb фільтрують в склянку з темного скла. Розчин повинен зберігатися в холодильнику.
Стандартний розчин Купруму
На аналітичних терезах зважують 0,98 г CuSO4·5H2O. Зважену масу переносять в мірну колбу на 25 мл, при цьому доливши до половини колби дистильованої води. Потім додають 1,3 мл концентрованої H2SO4 (обережно, дотримуючись техніки безпеки, за допомогою мірної піпетки).
5-% розчин цитрату амонію
На електронних терезах зважують 5 г лимонокислого амонію. Беруть колбу на 100 мл. Переносять туди 5 г солі та доводять дистильованою водою до мітки
За даними методики (1 мл містить 100 мкг Cu2+) концентрація вихідного стандартного розчину С = 10 мг/мл.
Проводять розбавлення стандартного розчину:
1. 0,5 мл вихідного розчину розбавляють водою до 50мл, утворився розчин 1 ;
2. 5 мл розчину 1 розбавляють водою до 50 мл, робочий вихідний розчин.
Тоді, відповідно концентрація розбавленого розчину: С = 10мкг/мл.
4.2 Проведення аналізу
У п'ять мірних колб на 25 мл відбирають піпеткою визначені об'єми стандартного розчину: 1 мл, 5 мл, 10 мл, 15 мл, 20 мл відповідно.
У ділильну лійку вносять: 25 мл природної води (з криниці масиву "Вишенька"), приливають 5 мл розчину цитрату амонію, 15 мл ДЕТК плюмбуму в CCl4 та відповідні об'єми стандартного розчину. Отриману суміш енергійно струшують 2 хвилини. Дають відстоятися. Після розділення фаз нижній органічний шар, забарвлений у жовто-коричневий колір, обережно зливають в суху пробірку з притертою пробкою.
Фотометрування проводять у кюветах з товщиною світлопоглинаючого шару 1 см при λ=436 нм (синій світлофільтр) відносно чистого CCl4 . Виконують 4 паралельних вимірювання природної води.
4.3 Обробка результатів
Табл.1 Дані для побудови градуювального графіка
| № розчину | 1 | 2 | 3 | 4 | 5 | Досл. р-н 1 | Досл. р-н 2 | Досл. р-н 3 | Досл. р-н 4 |
| А | 0,05 | 0,09 | 0,15 | 0,2 | 0,25 | 0,056 | 0,06 | 0,054 | 0,061 |
| m, мкг | 1 | 5 | 10 | 15 | 20 | 2 | 2,2 | 1,9 | 2,3 |
