Вода. Химические свойства. Природа межмолекулярных водородных связей. Аномальные свойства воды. Строение молекулы воды. Молекула воды - лиганд в аква-комплексах.
Покольку вода является универсальным растворителем, рассмотрим свойства воды. Самое распространенное вещество на земле – это вода. Почти 3\4 поверхности земного шара покрыта водой. Она является средой в которой протекают химические процессы в живых организмах и сама же участвует в биохимических процессах.
Вода главный катализатор всех жизненных процессов. Наш организм на 65-75% состоит из воды. Суточная потребность человека в воде составляет от 2 до 6 л и зависимость от нее намного сильнее чем от пищи. Многие пищевые продукты (овощи, фрукты, молоко, мясо) на 95-65% состоят из воды. Человечество широко использует для своих нужд природную воду. Основная часть воды приходится на Мировой океан. Запасы пресной воды, доступной для использования, составляют 0,15% объема гидросферы.
Физические свойства. Это жидкость без цвета и запаха. Рассмотрим особенности физико- химических свойств (аномалии) воды.
1. У воды аномально высокая полярность как растворителя.
µ = 1,84·10-29Клм (у Н2S - µ = 0,93·10-29Клм).
2. Вода имеет аномально высокую теплоемкость с = 75,3 Дж/моль К, у спирта в 1.5 раза больше, поэтому в ночное время и при переходе от лета к зиме она остывает медленно, а при обратном переходе нагревается медленно, т.о. регулируя температуру на земном шаре. При нагревании любого вещества кроме воды от 0 до 37оС теплоемкость увеличивается, а у воды уменьшается, далее увеличивается. Именно при 37оС организм затрачивает меньше энергии для поддержания температуры тела.
3. Аномально высокие температура Тпл = 0оС и температура Ткип = 100оС по сравнению с аналогами.
4. При 0оС вода замерзает. Плотность льда меньше чем у воды. При этом объем льда увеличивается на 9% .У других веществ уменьшается.
5. Плотность воды при переходе из твердого состояния в жидкое не уменьшается, а увеличивается. При нагревании воды от 0 до 4оС ее плотность также увеличивается. Плотность воды достигает максимального значения при 4оС - ρ = 0,998г/см3 .
Аномалии связаны со строением молекулы воды и образованием водородной связи между ними.
Молекула воды имеет угловое строение. Атом кислорода в молекуле воды находится в состоянии sp3- гибридизации. Поэтому валентный угол близок к тетраэдрическому (109о28').
Образование водородной связи приводит к ассоциации молекул. Каждый атом кислорода участвует в образовании двух водородных связей. Молекулы при кристаллизации образуют слои, причем каждая связана с тремя молекулами в этом слое и с одной из соседнего. Это приводит к образованию пустот.
При плавлении льда разрушается лишь часть водородных связей и объем воды уменьшается. При 0оС вода содержит остатки структуры льда. От 0 до 4оС плотность воды увеличивается за счет разрушения льда.
Высокая теплоемкость воды объясняется затратой тепла на разрыв водородных связей.
Химические свойства. Молекула Н2O устойчива к нагреванию. При температуре выше 1000оС она подвергается термической диссоциации, т.е. разложению
Н2O ↔ 2 Н2 + О2
Этот процесс протекает с поглощением тепла.
Вода очень реакционноспособное вещество. Оксиды многих металлов и неметаллов соединяются с Н2O образуя:
СаО + Н2O = Са(ОН)2
SО3 + Н2O = Н2SО4
Активные металлы реагируют с водой с выделением Н2.
Вода образует соединения с веществами не обладающими химической активностью (гидрат ксенона – Хе6Н2O). Хе заполнуют с водой с выделением Н2.
Вода образует соединения с веществами не обладающими химической активностью (гидрат ксенона – Хе6Н2O). Хе заполняет межмолекулярное пространство в структуре Н2O, образуя соединения, которые называются клатратами.
В аквакомплексах лигандами является H2O. Вода по классификации Льюиса является ДЭП (донором электронных пар), т.к. у атома кислорода в молекуле H2O есть 2 неподеленные электронные пары. За счет одной из них атом кислорода координируется к катиону металла.
Пероксид водорода. Состав и строение молекулы. Пероксиды. Надкислоты и надоснования. Получение пероксида водорода. Химические свойства. Окислительно-восстановительные свойства пероксидов. Пероксопроизводные d-элементов в высших степенях окисления. Их особенности.
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид
водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
Состав и строение молекулы. Молекула Н2O2 содержит в своем составе пероксидный анион O2-2 . Каждый атом кислорода образует 2 ковалентные связи, но имеет степень окисления, равную -1. В упрощенном виде строение молекулы отражает графическая формула:
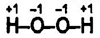
Физические свойства. В чистом безводном виде Н2O2 — бесцв. сиропообразная жидкость с плотностью 1,45 г/см3 (т. пл. -0,41°С, т. кип. 150,2°С). Смешивается с водой в любых соотношениях, растворяется также в спирте, эфире. 30%-ный р-р Н2O2 называют пергидролем. Подобно воде, Н2O2 — хороший полярный растворитель, в котором вещества с ионной и полярной ковалентной связью диссоциируют на ионы.
Химические свойства. Разложение Н2O2 (диспропорционирование)
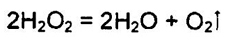
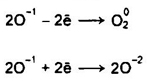
При Т > 90° С пероксид водорода разлагается практически полностью. Причиной непрочности молекул Н2O2 является неустойчивость атома кислорода в степепени окисления -1.