Строение коллоидных частиц лиофобных золей, электрокинетический потенциал.
Электрокинетические свойства коллоидных систем. Электрофорез, электроосмос. Строение коллидных частиц лиофобных золей, электрокинетический потенциал. Влияние электролитов на величину электрокинетического потенциала. Изоэлектрическое состояние. Устойчивость и коагуляция коллоидных систем. Коагуляция электролитами, правило Шульце-Гарди.
Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь (коллоидный раствор) состоит из двух частей: мицелл и интермицеллярной жидкости.
Мицелла – это частица дисперсной фазы золя, окруженная двойным электрическим слоем.
Интермицеллярной (межмицеллярной) жидкостью называют дисперсионную среду, разделяющую мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ, являющиеся стабилизаторами коллоидной системы.
Частицы дисперсной фазы лиофобных золей имеют сложную структуру, которая зависит от условий получения золей. Предположим, что золь иодида серебра AgI образуется в ходе химической реакции между AgNO3 и KI. При этом основу коллоидных частиц составят микрокристаллы труднорастворимого AgI, включающие в себя m молекул AgI (а точнее, m пар ионов Ag+ и I-). Эти микрокристаллы называют агрегатами. Если реакция протекает в присутствии избытка иодида калия, то на поверхности агрегата возникает отрицательно заряженный слой в результате избирательной адсорбции n ионов I-. Иодид-ионы являются потенциалобразующими ионами (сокращенно ПОИ). Агрегат вместе с потенциалобразующими ионами является частицей твердой фазы и его называют ядром.
Под действием электростатических сил к ядру притягивается n ионов противоположного знака – противоионов, компенсирующих заряд ядра. В данном случае эту роль выполняют ионы K+. Часть противоионов (n - x), наиболее близко расположенных к ядру, находится в слое жидкости, смачивающем поверхность твердого ядра. Эти ионы испытывают действие не только электростатических, но и ван-дер-ваальсовых сил ядра, поэтому прочно удерживаются около него и образуют так называемый адсорбционный слой противоионов. Ядро с адсорбционным слоем противоионов образует коллоидную частицу. Остальные x противоионов, слабее связанных с ядром (только электростатически), под влиянием теплового движения располагаются в жидкой фазе диффузно (размыто), почему и носят название диффузного слоя. Все это образование вместе и является мицеллой.
Мицеллы золей электронейтральны. Структуру мицеллы можно записать в виде формулы:
 ,
,
где m – число молекул, входящих в состав агрегата, n – число потенциалобразующих ионов, (n – x) – число противоионов, входящих в адсорбционный слой, x – число противоионов, образующих диффузный слой.
Числа m, n и x могут изменяться в широких пределах в зависимости от условий получения и очистки золя. Обычно m >> n. Ядро вместе с адсорбционным слоем противоионов образуют собственно коллоидную частицу, или гранулу. В отличие от электронейтральной мицеллы коллоидная частица имеет заряд, в данном случае - отрицательный (x‑).
Граница между коллоидной частицей и диффузным слоем носит название поверхность скольжения. В формуле мицеллы этой границе соответствует фигурная скобка между адсорбционным и диффузным слоями (на рис. 1 - сплошная линия).

Рис. 1. Схема строения мицеллы золя иодида серебра
с отрицательно заряженными частицами.
Граница скольжения обозначает ту геометрическую поверхность, по которой происходит разделение («разрыв») мицеллы на коллоидную частицу и диффузный слой в случае ее перемещения относительно дисперсионной среды (например, при участии мицеллы в броуновском движении или при движении под действием электрического поля).
На границе раздела твердое тело – жидкость возникает двойной электрический слой. Согласно современным представлениям, двойной электрический слой (ДЭС) - это образующийся на границе двух фаз тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака (потенциалобразующих ионов и противоионов). Потенциалобразующие ионы, адсорбирующиеся на твердой поверхности, - это внутренняя обкладка ДЭС. Внешняя обкладка ДЭС (слой противоионов) состоит из двух частей: плотной и диффузной.
Образование двойного слоя ионов приводит к появлению определенных электрических потенциалов на границе раздела твердой и жидкой фаз. Ионы первого слоя (внутренней обкладки), фиксированные на твердой поверхности, придают этой поверхности свой знак заряда и создают на ней так называемый поверхностный или φ-потенциал. Знак φ-потенциала совпадает со знаком заряда потенциалобразующих ионов. Величина φ-потенциала пропорциональна числу зарядов этих ионов на поверхности частиц.
С точки зрения термодинамики, φ-потенциал равен работе переноса единичного (элементарного) заряда из бесконечно удаленной точки объема раствора на поверхность твердой фазы, т. е. представляет собой потенциал твердой поверхности. Прямых методов его измерения не имеется.
Второй потенциал, характеризующий двойной слой ионов, называют электрокинетическим потенциалом или x-потенциалом (дзета-потенциалом). Он представляет собой электрический потенциал в двойном слое на границе между коллоидной частицей, способной к движению в электрическом поле и окружающей жидкостью. x-потенциал является потенциалом поверхности скольжения. Однако в двойном электрическом слое точное расстояние от твердой поверхности до поверхности скольжения неизвестно. Поэтому приближенно можно принять, что поверхность скольжения проходит по границе между адсорбционным и диффузным слоями противоионов. Следовательно x-потенциал близок, хотя и не совсем равен, потенциалу на границе адсорбционного и диффузионного слоев.
Термодинамически ξ-потенциал можно определить как работу, необходимую для переноса единичного заряда из бесконечно удаленного элемента объема раствора на поверхность скольжения. Знак ξ-потенциала обычно совпадает со знаком φ-потенциала. ξ-потенциал является частью φ‑потенциала и всегда меньше, чем φ‑потенциал. Величина ξ-потенциала непосредственно связана с числом противоионов в диффузном слое и изменяется пропорционально этому числу. Можно считать, что с увеличением толщины диффузного слоя ξ‑потенциал повышается. Поскольку электрокинетический потенциал относится к коллоидной частице и обусловливает ее подвижность в электрическом поле, величина этого потенциала может быть измерена экспериментально по скорости движения частиц. Направление же перемещения частиц к катоду или аноду указывает на знак ξ-потенциала.
Благодаря наличию ξ-потенциала на границах скольжения всех частиц дисперсной фазы возникают одноименные заряды и электростатические силы отталкивания противостоят процессам агрегации. Таким образом, ξ-потенциал является одним из основных факторов агрегативной устойчивости гидрофобных золей. Величина, а иногда и знаки φ- и ξ-потенциалов могут изменяться под влиянием внешних воздействий (электролитов, разведения, повышения температуры). Особенно чувствителен к этим факторам ξ-потенциал.
14.2.Электрокинетические свойства коллоидных систем: электрофорез, электроосмос.
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов.
Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом - опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались.
Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу, названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном (1878). При оседании частиц суспензии кварца под действием силы тяжести возникала разность потенциалов между уровнями разной высоты в сосуде.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Из описанных явлений электрофорез имеет наиболее широкое практическое применение. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда частиц. Подвижность частиц в электрическом поле обусловлена тем, что при наложении внешней разности потенциалов происходит разрыв двойного электрического слоя по границе скольжения и частица получает заряд, соответствующий ее ξ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Очевидно, что скорость движения частиц дисперсной фазы пропорциональна величине их ξ‑потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ξ‑потенциала коллоидной частицы.
Величина ξ‑потенциала связана со скоростью электрофореза заряженных частиц зависимостью, названной уравнением Гельмгольца – Смолуховского:
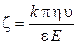 , (1)
, (1)
где k — коэффициент, зависящий от формы частиц (для сферических частиц k = 6, для цилиндрических k = 4); η – вязкость среды; υ – линейная скорость перемещения частиц (или границы золя); ε – относительная диэлектрическая проницаемость среды; Е – напряженность поля (градиент потенциала).
Линейная скорость υ изменяется пропорционально напряженности поля Е, поэтому не может служить характеристикой частиц. В связи с этим введено понятие электрофоретической подвижности υэф., равной скорости движения частицы при единичном градиенте потенциала (Е = 1):
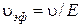 . (2)
. (2)
Экспериментально найденные значения подвижностей часто оказываются меньше расчетных. Несовпадение этих величин объясняете в основном тем, что теория Гельмгольца - Смолуховского не учитывает два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны.
Методы электрофореза имеют большое теоретическое и практическое значение. Знание величины ξ-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку изменение его устойчивости, как правило, происходит пропоционально изменению электрокинетического потенциала.
Электроосмос, как и электрофорез, получил широкое применение. Механизм электроосмоса заключается в следующем. Нерастворимый материал мембраны при контакте с жидкостью (водой) диссоциирует с поверхности, отщепляя в жидкость те или другие ионы. Возникает двойной электрический слой, внутренняя обкладка которого входит в состав твердой фазы, а противоионы диффузно располагаются в жидкости. При включении постоянного электрического тока противоионы диффузного слоя перемещаются к электроду соответствующего знака. Так как ионы в воде всегда гидратированы, то при движении иона с ним увлекается определенный объем дисперсионнной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Очевидно, что чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Дли этой цели применяют, например, электрофильтр-прессы.