Желчные кислоты.
Синтезируются в печени из холестерина, т.е. в основе их структуры лежит циклопентанпергидрофинантреновое кольцо.
Бывают первичные и вторичные:
-первичные (холевая и хенодезоксихолевая)
Они синтезируются в печени путем гидроксилирования (с участием О2, НАДФН и
цитохрома Р450)затем поступают в желчный пузырь, где они существуют в
видеконъюгатов с глицином или таурином (биогенный аммин), получается гликохолевая
или таурохолевая кислоты.
Т.к. в желчи много натрия и калия, то конъюгаты находятся в виде солей кроме желчных
кислот в желчи содержится ~ 5% холестерина, ~ 15% фосфолипидов, -80% желчных
солей. Если это соотношение повышается в сторону холестерина, то он выпадает в
осадок в виде камней.
Желчные кислоты поступают в желчный пузырь постоянно, а выбрасываются из него в
процессе пищеварения.
-вторичные образуются из первичных под действием микрофлоры кишечника. Из холевой образуется литохолевая, из хенодезоксихолевой - дезоксихолевая кислота. Желчные кислоты способствуют активированию панкреатической липазы и всасыванию продуктов гидролиза жиров. Только 5% желчных кислот выводится из организма, остальная часть всасывается в кишечник, поступает в печень и используется повторно, т.е. циркулирует (энтерогепатическая циркуляция).
На эмульгированные жиры действует панкреатическая липаза, расщепляя сложноэфирные связи в а-положении. Отщепление жирных кислот в р-положении происходит медленнее, следовательно, продуктами гидролиза являются жирные кислоты, глицерин и β-МАГ.
Всасывание продуктов гидролиза.
Глицерин и жирные кислоты с кроткой цепью всасываются самостоятельно, а β-МАГ и жирные кислоты с длинной цепью всасываются при помощи мицелл. Мицеллы - это шаровидные образования, имеющие гидрофобное ядро (β-МАГ, жирные кислоты с длинной цепью, жирорастворимые витамины: А, Д, Е, К) и эфиры холестерины. Гидрофильная поверхность образована желчными кислотами и холестерином. Мицеллы всасываются в тонком кишечнике, в клетках слизистой оболочки кишечника они распадаются на желчные кислоты, холестерин, жирорастворимые витамины: А, Д, Е, К, β-МАГ, жирные кислоты.
Ресинтез в клетках слизистой кишечника. Существует заболевание стеаторрея (жирный кал). Причины:
1. закупорка желчных протоков или фистула желчного пузыря (желчные кислоты не
поступают в кишечник)
2. заболевание поджелудочной железы: жиры эмульгируются, но не расщепляются
липазой, выводятся с калом,
3. нарушение всасывания (диарея)
Ресинтез - это синтез жиров из продуктов гидролиза, в результате чего образуется жир,
характерный для каждого организма, т.к. в состав жира включаются жирные кислоты
собственного организма (эндогенные).
Ресинтез начинается с активирования жирных кислот, идет с участием энергии АТФ,
КоА и фермента ацилКоА синтетазы, активированная форма жирных кислот называется
ацилКоА.
 Реакция ресинтеза жиров или ТАГ включает взаимодействие β-МАГ с двумя молекулами активированной жирной кислоты. Ферменты: триацилглицеролсинтетаза, в результате образуется ТАГ, специфические для данного организма.
Реакция ресинтеза жиров или ТАГ включает взаимодействие β-МАГ с двумя молекулами активированной жирной кислоты. Ферменты: триацилглицеролсинтетаза, в результате образуется ТАГ, специфические для данного организма.
Ресинтезированные жиры нерастворимы в воде —» в кишечнике образуются транспортные формы жиров - хиломикроны (ХМ), (транспортируют экзогенные или пищевые жиры, имеют гидрофобное ядро и гидрофильную оболочку. Ядро включает в себя ТАГ, эфиры Хс, А, Д, Е, К, поверхность образована монослоем фосфолипидов, полярные головы которых направлены к воде, а неполярные гидрофобные жирнорастворимые хвосты к ядру. На поверхности этих частиц находятся специфические белки - апопротеины). ХМ в кишечнике образуются под действием апопротеина В48. Образовавшиеся ХМ -незрелые. Состав ХМ в процентах: белки - 2%, фосфолипиды -3%, холестерин - 2%,
ЭХс - 3%, ТАГ - 90%—»ХМ - основная транспортная форма жиров. ХМ - большие,
самые крупные из всех липопротеинов, поэтому они не проникают в кровеносные
сосуды, а ХМ незрелые поступают в лимфатические сосуды, потом через лимфатический
проток поступают в сосуды, где превращаются в зрелые ХМ, т.к. получает от
липопротеинов высокой плотности (ЛВП) апобелки С2 и Е.
В дальнейшей судьбе ХМ принимают участие жировая ткань и печень. В крови ХМ
зрелые подвергаются действию ЛП-липазы (фермент, локализованный на поверхности
эндотелия капилляров). Этот фермент узнает ХМ зрелые взаимодействуя с оспобелком
С2, который активирует этот фермент. В результате ТАГ ХМ зрелые гидролизуются
этой липазой на глицерин и жирные кислоты. Глицерин поступает в печень, где
участвует в синтезе эндогенных жиров или фосфолипидов, а жирные кислоты
депанируются в жировой ткани в виде ТАГ, либо окисляется в сердце, в мышцах и
других органах, кроме мозга. В результате действия ЛП-липазы образуются остаточные
ХМ. Они захватываются печенью посредством апобелка энергии и под действием
лизосомальных ферментов распадаются на Хс, ЭХс, А, Д, Е, К, апопротеины и 10% ТАГ.
В кишечнике синтезируется в небольшом количестве другая транспортная форма -
ЛОНП (липопротеины очень низкой плотности), они поступают в кровь , затем в
жировую ткань, где под действием ЛП-липазы из них извлекаются жиры, которые
депонируются, а из ЛОНП в результате извлечения жиров образуются ЛНП, содержащие
до 50% Хс и ЭХс.
ЛНП частично захватываются печенью.
После приема жирной пищи концентрация ХМ и липопротеинов повышается через 4-5
часов (сыворотка мутная или белая), а затем концентрация понижается, т.к. действует
ЛП-липаза. При дефекте ЛП-липазы в крови повышается концентрация ЛОНП и ХМ,
сыворотка остается мутноватой - гиперхиломикронемия или гиперлипопротеинемия.
От жировых депо, где ТАГ распадаются на жирные кислоты и глицерин под действием
ЛП-липазы (или ТАГ-липазы). Жирные кислоты в комплексе с альбумином
транспортируются к органам и тканям, где подвергаются расщеплению с целью
извлечения энергии. Мозг не использует жирные кислоты. Этот процесс называется р-
окисление жирных кислот.
β-окисление - это специфический путь катаболизма жирных кислот до ацетилКоА,
протекает в почках, в мышцах, особенно интенсивно в печени, кроме мозга, в
митохондриях.
Значение процесса - извлечение энергии из жирных кислот. Процесс назван так из-за
окисления группы-СН в р-положении. Процесс циклический, в конце каждого цикла
молекула ЖК укорачивается на 2 углеродных атома в виде ацетилКоА, который
поступает в ЦТК, а укороченная на 2 атома углерода ЖК поступает в новый цикл.
Многократное повторение процесса приводит к полному расщеплению ЖК до
ацетилКоА.
Регуляторный фермент скорость лимитирующий фермент
карнитинацилКоАтрансфераза 1, активируется этот фермент гормоном голода -
глюкагоном. Ингибируется - инсулином и регуляторным ферментом синтеза ЖК
(ацетилКоАкарбоксилаза).
Прежде чем вступить в β-окисление ЖК должна превратиться в активированную форму
- ацилКоА (см. Ресинтез жиров).
Активирование происходит в цитоплазме. Мембрана митохондрий непроницаема для
активированных ЖК, их перенос происходит при участии специфического переносчика
карнитина. Под действием ферментов карнитинацилКоАтрансферазы 1и 2
активированная ЖК присоединяется сложноэфирной связью к спиртовой группе карнитина, образуется комплекс ацилкарнитин. Он диффундирует в митохондрию, где с помощью специфических ферментов ацильная группа с карнитина переносится на КоА. Перенесенная в митохондрии ЖК подвергается β-окислению включая 4 реакции в одном цикле, 2 из них имеют непосредственную связь с ЦПЭ, т.к. это реакции окисления.
В последнем цикле образуется 2 молекулы ацетилКоА.
Подсчет энергии.
Для того, чтобы подсчитать энергетический выход процесса необходимо найти число
ацетилКоА, образующихся при р-окислении и число циклов, необходимых для
расщепления ЖК.
Сп=10
Число ацетилКоА = n/2 — 10/2=5
В данном случае число ацетилКоА = 5 —> ЦТК à 5* 12=60АТФ
Число циклов = п/2 -1=4, т.к. в последнем цикле образуется 2 молекулы ацетилКоА.
В каждом цикле есть 2 реакции окисления:
1- идет с участием НАД —► Р/О = 3
2- идет с участием ФАД —> Р/О — 2, т.е. в каждом цикле за счет водородов от окисляемых
субстратов 1 и 3 реакции, в сопряженном синтезе образуется 5 АТФ, 5*4 = 20 АТФ
Итог: 20 + 60 =80АТФ - 1 АТФ (на активирование ЖК) - 79
79 АТФ выделится при окислении 10-углеродной ЖК.
ЖК с нечетным числом углеродных атомов окисляется аналогично, в последнем цикле
образуется вместе с ацетилКоА пропионилКоА —► в ЦТК энергетический выход будет
немного ниже.
Регуляторный фермент р-окисления активируется в период пониженной концентрации
УВ, а именно, при мышечной нагрузке и в период между приемами пищи. Период после
приема пищи называется абсорбционный, период между приемами пищи -
постабсорбционный.
Биосинтез кетоновых тел.
Кетоновые тела - это β-гидроксимасляная кислота или р-гидроксибутират, ацетоуксусная кислота или ацетоацетат, ацетон (только при патологии). Нормальная концентрация кетоновых тел в крови Змг в 100 мл или 0,03-0,05 ммоль/л. Основное кетоновое тело - это β-гидроксибутират.
Синтезируется только в печени, используется организмом в качестве источника энергии, при длительном голодании даже мозгом. Не использует кетоновые тела печень. Субстратом для синтеза является ацетилКоА (получаемый при β-окислении). Часть ацетилКоА поступает в 1ДТК, часть на синтез кетоновых тел. Процесс протекает в митохондриях. В результате синтеза кетоновых тел образуется вещество -промежуточное соединение, которое играет большую роль при синтезе кетоновых тел или Хс - это вещество называется 3-гидрокси-β-метилглутарилКоА (ГМГКоА). 2 молекулы ацетилКоА под действием фермента тиолаза превращается в ацетоацетилКоА. Он под действием фермента 3-гидрокси-β-метилглутарилКоАсинтетазы с участием еще одной молекулы ацетилКоА образует β-гидрокси-β-метилглутарилКоА. Под действием β-гидрокси-β-метилглутарилсинтетазы образуется ацетоацетат. Про патологии происходит декарбоксилирование ацетоацетата с образованием ацетона.
Распад кетоновых тел.
Для того, чтобы кетоновые тела использовались в качестве источника энергии, необходимо активировать ацетоуксусную кислоту. Реакция протекает под действием фермента сукцинилКоАацетоацетаттрансферазы (его нет в печени, поэтому печень кетоновые тела не использует).
Подсчитаем сколько молекул АТФ выделяется при расщеплении ацетоуксусной кислоты - 24 молекулы АТФ. Так как при регенерации сукцината в сукцинилКоА затрачивается 1 АТФ, то общее количество АТФ - 23 молекулы. При окислении β-гидроксибутирата - 3 АТФ + 23 = 26 АТФ выделяется.
При патологических состояниях, таких как сахарный диабет (недостаток инсулина) или при длительном голодании скорость синтеза кетоновых тел резко повышается и концентрация их в крови повышается до 90мг /100мл, а при сахарном диабете - до 140мг/100мл. При этих состояниях образуется ацетон, который выделяется с выдыхаемым воздухом, такое состояние называется кетоз. В результате накопления этих кислот в крови рН сдвигается в кислую сторону и такое состояние организма называется метаболический некомпенсированный ацидоз (помочь можно в/в введении гипертонического раствора глюкозы).
Почему при голодании и сахарном диабете концентрация кетоновых тел резко увеличивается? В условиях длительного голодания и сахарного диабета, когда клетки находятся в состоянии энергетического голода (нет глюкозы) и поэтому —> основным источником энергии в этих условиях становятся ЖК, в составе жиров, депонированных в жировой ткани. Распад жиров активируется глюкагоном (гормон голода), расщепившиеся жиры жировой ткани на глицерин и ЖК, мобилизуются, глицерин идет в печень, а ЖК подвергаются β-окислению во всех органах, кроме мозга. В результате образуется много ацетилКоА, который в норме практически весь поступил бы в ЦТК, но в условиях голодания и сахарного диабета ЦТК тормозится, т.к. оксалоацетат будет использоваться для синтеза глюкозы в глюконеогенезе, необходимой для работы мозга в этих условиях, т.к. мозг ЖК не использует.
Поэтому основное количество ацетилКоА, образующегося при р-окислении, идет на синтез кетоновых тел à их концентрация повышается.
Биосинтез высших ЖК.
Это синтез их из ацетилКоА, полученного при расщеплении углеводов. Протекает в цитоплазме и наиболее интенсивно в печени, в почках, в молочной железе в период лактации. В организме человека синтезируется в основном пальмитиновая кислота (С 16), а в митохондриях гепатоцитов происходит удлинение цепей синтезированных ЖК.
Регуляторная реакция процесса - образование из ацетилКоА малонилКоА под действием фермента ацетилКоАкарбоксилаза, коферментом является биотип или витамин Н. Активируется этот фермент гормоном инсулином, в период достаточного поступления углеводов (много глюкозы —> гликолиз —»ПВК —» много ацетилКоА для синтеза ЖК). Данный регуляторный фермент ингибирует регуляторный фермент β-окисления (карнитинацилтрансферазу).
В синтезе ЖК во всех этапах вместо HSKoA участвует ацилпереносящий белок (АПБ). В двух реакциях будет участвовать кофермент НАДФН, как источник Н в реакциях восстановления (НАДФН из пентозофосфатного пути).
Синтез ЖК «похож» на β-окисление, но наоборот: процесс циклический, но в конце каждого цикла происходит удлинение цепи ЖК на 2 углеродных атома. В конце синтеза пальмитиновой кислоты происходит отщепление АПБ. Процесс синтеза осуществляется пальмитатсинтетазным комплексом. Это доменный белок (состоит из 1 ППЦ, которая в нескольких участках формирует домен, в третичной структуре обладающий ферментативной активностью).
Включает в себя 6 участков, обладающих ферментативной активностью. Все вместе они объединены в АПБ, который связан с фосфопантонеатом (фосфорилированная пантотеновая кислота с SH-группой на конце). На этом конце и протекают все реакции, то есть S не выделяется в среду. Пальмитатсинтетаза имеет 2 функциональные единицы, каждая из которых синтезирует 1 пальмитиновую кислоту.
Строение пальмитатсинтетазного комплекса.

1 фермент - трикетоацилсинтаза
2 - трансацилаза
3 - еноилредуктаза (фермент, у которого в качестве кофермента будет НАДФН)
4 - гидротаза
5 - кетоацилредуктаза (НАДФН+Н+)
6 - тиоэстераза (будет отщеплять синтезированную ЖК от АПБ)
Синтез жиров (ТАГ).
Обмен жиров или ТАГ включает в себя несколько стадий: 1). Синтез жиров (из глюкозы, эндогенные жиры), 2). Депонирование жиров, 3). Мобилизация.
В организме жиры могут синтезироваться из глицерина и из глюкозы. Основные 2 субстрата для синтеза жиров:
1) α-глицеролфосфат (α-ГФ)
2) ацилКоА (активированная ЖК).
Синтез ТАГ происходит через образование фосфатидной кислоты.
α-ГФ в организме человека может образовываться двумя путями: в органах, в которых активен фермент глицеролкиназа, ГФ может образоваться из глицерина, в органах, где активность фермента низкая, ГФ образуется из продуктов гликолиза (т.е. из глюкозы).
Если в реакцию вступает восстановленная форма НАД (НАДН+Н ), то это реакция
восстановления и фермент называется по продукту + «ДГ».
Биосинтез ТАГ наиболее интенсивно протекает в печени и жировой ткани. В жировой
ткани синтез ТАГ протекает из УВ, т.е. часть глюкозы, поступившей с пищей может
превращаться в жиры (когда углеводов поступает больше, чем необходимо для
возобновления запаса гликогена в печени и мышцах).
Жиры, синтезированные в печени (двумя путями) упаковываются в частицы ЛОИП,
поступают в кровь —> ЛП-липазе, которая гидролизует ТАГ или жиры из этих частиц на
ЖК и глицерин. ЖК поступают в жировую ткань, где депонируются в виде жиров, либо
используются как источник энергии органами и тканями (р-окисление), а глицерин
поступает в печень, где может использоваться для синтеза ТАГ или фосфолипидов.
В жировой ткани депонируются жиры, которые образованы из глюкозы, глюкоза дает
оба или 2 субстрата для синтеза жира.
После приема пищи (абсорбционный период) f концентрация глюкозы в крови, |
концентрация инсулина, инсулин активирует:
1. транспорт глюкозы в адипоциты,
2. ЛП-липазу.
—► активирует синтез жира в жировой ткани и его депонирование —> существует 2 источника жиров для депонирования в жировой ткани:
1. экзогенные (ТАГ из хиломикронов и ЛОНП кишечника, переносящие пищевые
жиры)
2. эндогенные жиры (из ЛОНП печени и образующиеся ТАГ в самих жировых
клетках).
Мобилизация жиров - это гидролиз жиров, находящихся в адипоцитах до ЖК и глицерина, под действием гормонзависимой ТАГ-липазы, которая находится в клетках и активируется в зависимости от потребностей организма в источниках энергии (в постабсорбтивном периоде, т.е. в промежутках между приемами пищи, при голодании, стрессе, длительной физической работе, т.е. активируется адреналином, глюкагоном и соматотропным гормоном (СТГ).
При длительном голодании концентрация глюкагона увел., это приводит к снижению синтеза ЖК, увеличению β-окисления, увеличеню мобилизации жиров из депо, увеличен синтез кетоновых тел, увеличен глюконеогенез.
Отличие действия инсулина в жировой ткани и печени:
↑ концентрации инсулина в крови приводит к ↑ активности ПФП, ↑ синтеза ЖК, ↑ гликолиза (глюкокиназа, фосфофруктокиназа (ФФК), пируваткиназа - ферменты гликолиза; глюкозо-6-ДГ - фермент ПФП; ацетилКоАкарбоксилаза - фермент синтеза ЖК).
В жировой ткани активируется ЛП-липаза и депонирование жиров, активируется поступление глюкозы в адипоциты и образование из нее жиров, которые тоже депонируются.
В организме человека существует 2 формы депонированного энергетического материала:
1. гликоген; 2. ТАГ или нейтральные жиры.
Отличаются по запасам и очередности мобилизации. Гликогена в печени от 120-150г, может быть до 200, жиров в норме ~ 10кг.
Гликогена хватает (в качестве источника энергии) на 1 сутки голодания, а жиров - на 5-7 недель.
При голодании и физической нагрузке в первую очередь используются запасы гликогена, затем постепенно нарастает скорость мобилизации жиров. Кратковременные физические.
нагрузки обеспечиваются энергией, за счет распада гликогена, а при длительных физических нагрузках используются жиры.
При нормальном питании количество жиров в жировой ткани постоянно, но жиры постоянно обновляются. При длительном голодании и физических нагрузках скорость мобилизации жиров больше, чем скорость депонирования à количество депонированных жиров уменьш. (похудение). Если скорость мобилизации ниже, чем скорость депонирования - ожирение.
Причины: несоответствие между количеством потребляемой пищи и энергозатратами организма, и поскольку мобилизация и депонирование жиров регулируются гормонами —» ожирение является характерным признаком эндокринных заболеваний.
Обмен холестерина. Биохимические основы возникновения атеросклероза. Основные функции холестерина в организме:
1. основная: большая часть Хс используется для построения клеточных мембран;
2. Хс служит предшественником желчных кислот;
3. служит предшественником стероидных гормонов и витамина D3 (половые
гормоны и гормоны коры надпочечников).
В организме на долю Хс приходится основная масса всех стероидов ~ 140г. Синтезируется Хс в основном в печени (-80%), в тонком кишечнике (-10%), в коже (-5%), скорость синтеза Хс в организме зависит от количества экзогенного Хс, если с пищей поступает более 1г Хс (2-3г) синтез собственного эндогенного Хс ингибируется, если Хс поступает мало (вегетарианцы) скорость синтеза эндогенного Хс |. Нарушение в регуляции синтеза Хс (а также образование его транспортных форм —> гиперхолестеринемия —» атеросклероз —> ИБС —► инфаркт миокарда). Норма поступления Хс >1г (яйца, масло (сливочное), печень, мозг).
Синтез холестерина.
Хс с пищей поступает преимущественно в виде эфиров Хс (Хс этерифицирован ЖК по третьему положению). В кишечнике под действием фермента холестеролэстеразы ЭХс расщепляется на Хс и ЖК. После всасывания в кишечнике Хс этерифицируется и образуются ЭХс. Этот Хс и Хс, синтезированный в кишечнике (10%), встраиваются в хиломикроны (90%) и ЛОНП (10%) —> кровь —> ЛП-липаза . Под действием ЛП-липазы из хиломикронов и ЛОНП извлекаются жиры или ТАГ. Из хиломикронов образуются остаточные хиломикроны —> печень, где из них высвобождается Хс, который используется для синтеза желчных кислот, либо при избыточном поступлении ингибирует синтез собственного Хс, а из ЛОНП образуется ЛНП (содержание Хс, в которых более 50 %). На поверхности ЛНП находится апобелок β100. ЛНП —> органы и ткани, где клетки узнают ЛНП, за счет β100.
ЛНП поглощается клетками, содержащийся в них Хс используется для нужд клетки (для построения мембран).
Таким образом, функция ЛНП - снабжение Хс органов и тканей организма. В печени синтезируется собственный Хс, ферменты синтеза Хс имеются во всех клетках, имеющих ядро. Синтезируется Хс из ацетилКоА. Различают 3 этапа:
1. образование мевалоновой кислоты;
2. образование сквалена;
3. образование Хс.
1 этап протекает в цитоплазме, а остальные метаболиты не растворимы в воде à 2иЗ этапы протекают в мембранном слое ЭПР.
1 стадия похожа на синтез кетоновых тел. Регуляторная реакция - образование мевалоновой кислоты, катализируется регуляторным ферментом. ГМГ-редуктазой, она необратима, скорость лимитирующая. Этот фермент регулируется:
1. аллостерически, по механизму обратной отрицательной связи Хс или его
производными, ингибируется фермент экзогенным Хс, поступающим с пищей (более 1г в
сутки), желчными кислотами, активируется инсулином, эстрогенами,
2. изменяется количество фермента, которое контролируется на уровне экспрессии гена.
Биосинтез Хс.
На синтез одной молекулы Хс (С27 необходимо 18 молекул АТФ и 18 молекул ацетилКоА.
 2 стадия: мевалоновая кислота превращается в сквален.
2 стадия: мевалоновая кислота превращается в сквален.

 3 стадия■
3 стадия■
сквален
холестерин
Синтезируемый в печени Хс упаковывается в ЛОНП вместе с жирами, которые поступают в кровь, из них образуются ЛНП, которые снабжают Хс органы и ткани. Как предотвратить накопление Хс в органах и тканях?
Этому способствуют другие транспортные частицы: ЛВПЗ, которые синтезируются в печени и содержат небольшое количество Хс. Они поступают в кровь, взаимодействуют с ЛНП либо с клетками тканей —> кровь, забирают избыток Хс из них.
Функционирование ЛНП и ЛВП поддерживает гомеостаз Хс в клетках.
Каким образом ЛВП забирают избыток Хс из других липопротеинов, органов и тканей?
Это связано с присутствием на поверхности ЛВПЗ фермента, который называется
лицетинХсацилтрансфераза (ЛХАТ). Здесь же на поверхности присутствует его
кофактор - А1. Этот фермент отщепляет ЖК от фосфолипидов на поверхности ЛВПЗ и
переносит ее на гидроксильную группу Хс.
В результате образуются ЭХс.
ЭХс - гидрофобные, погружаются внутрь ЛВПЗ.
Концентрация Хс на поверхности снижается и освобождается место для Хс и других
частиц.
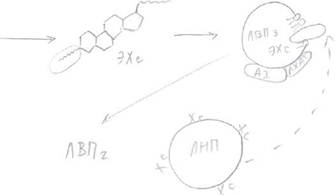
|

|
Таким образом ЛВПЗ извлекают Хс из мембран клеток. В результате образуется ЛВП2 с
большим содержанием Хс —> печень, там распадается.
Хс используется для синтеза желчных кислот. В конечном итоге избыток Хс выводится с
желчью, либо в виде свободного Хс, либо в виде желчных кислот. Около 1г Хс
выводится из организма с фекалиями. 50% в составе желчи, в виде желчных кислот и
50% в виде капростенола, который образуется из Хс в нижних отделах кишечника под
действием микрофлоры.
Нарушение баланса между ЛНП и ЛВП может привести к липопротеинемиям. Например,
гиперхиломикронемия (дефект ЛП-липазы), гиперхолестеринемия (нарушение
поглощения ЛНП клетками), увел. концентрации Хс - основной патогенетический фактор
развития атеросклероза.
Главное проявление: отложение Хс в стенках в основном, крупных сосудов.
Предрасположенность к нему считается по коэффициенту атерогенности.
ЛНП еще называют атерогенными.
Для возникновения атеросклероза имеют значение первичные повреждения кровеносных
сосудов: при гипертонии, воспалительных процессах, сахарном диабете, нарушении
свертываемости, действии токсических веществ (например, курении). В результате
нарушается барьер проницаемости сосудов (повышаются промежутки между
эндотелиальными клетками, в эти области проникают ЛНП, которые поглощаются
макрофагами, все компоненты ЛНП разрушаются лизосомальными ферментами, кроме
Хс) —>Хс накапливается, инкапсулируется соединительной тканью, образуется
атеросклеротическая бляшка, в которую могут откладываться соли Са.
В результате стенки сосудов деформируются, сужается их просвет. При атеросклерозе
поток ЛНП в клетке преобладает.
Профилактика атеросклероза.
Диета и потребление ненасыщенных жирных кислот, которых много в растительном масле. N Хс = 3,6 - 6,4 ммоль/л, человек должен стремиться к значению 5,5 ммоль/л.
Обмен нуклеотидов.План:
1. переваривание нуклеиновых кислот (НК)
2. синтез пуриновых нуклеотидов
3. синтез пиримидиновых нуклеотидов
4. катаболизм пуриновых нуклеотидов
5. катаболизм пиримидиновых нуклеотидов
6. синтез дезоксирибонуклеотидов
1. Ни нуклеотиды, ни пуриновые основания исходные, поступившие с пищей, не
включаются в НК тканей человека, а также не в пуриновые и пиримидиновые
коферменты (НАД, ФАД, КоА).
В организме человека нуклеотиды, необходимые для синтеза НК, синтезируются заново или деново.
Нуклеотиды поступают в организм, в составе НК, а НК в составе нуклеопротеинов (икра, печень, молока, почки, рыба, шоколад, кофе, какао, чай, красное вино, мясо, яйца, молоко, сыр - практически нет).
Под действием фермента поджелудочной железы рибонуклеазы и дезоксирибонуклеазы расщепляют 3,5-фосфодиэфирные связи и НК расщепляются до нуклеотидов. Нуклеотидазы и фосфатазы гидролизуют нуклеотиды до нуклеозидов. Нуклеозиды либо всасываются, поступают в печень, где подвергаются катаболизму, либо небольшое количество расщепляется до пуриновых и пиримидиновых оснований в слизистой кишечника под действием фосфатазы, здесь же могут окисляться, т.е. расщепляться до конечных продуктов, которые всасываются и затем выводятся с мочой.
2. Синтезируются пуриновые и пиримидиновые нуклеотиды из СО^ , аспарагиновой
кислоты, глутамата, глицина и рибозы.
Путь синтеза пуринов завершается образованием икозин-5-монофосфата, который затем превращается в АМФ и ГМФ. Конечный продукт синтеза пиримидинов-УМФ, который является предшественником других пиримидинов. В обоих синтезах участвует ТГФ (Н4-фолат), как переносчик одноуглеродных фрагментов. Азотистые основания синтезируются из простых соединений, донорами С и N служат:
 глицин
глицин
Для пуриновых нуклеотидов существует 2 пути:
1. сборка из мелких фрагментов
2. из азотистых оснований, полученных при катаболизме (20% от общего синтеза,
называется «путь спасения»)
Синтез включает много реакций:

|
ПФП поставляет нам рибозо-5-фосфат, который под действием АТФ и 1 фермента превращается в фосфорибозилпирофосфат, который под действием второго фермента и амидной группы глутамина превращается в фосфорибозил-1-амин. ИМФ - инозинмонофосфат ТМФ - гуанозинмонофосфат
Ферменты.
1 - ФРПФ синтетаза (фосфорибозилпирофосфатсинтетаза)
2 - регуляторный (амидофосфорибозилтрансфераза)
3-ИМФ-ДГ
4 - ГМФ-синтетаза
5 - аденилосукцинатсинтетаза
6 - аденилосукциназа.
Регуляция синтеза нуклеотидов.
Основную роль в регуляции играет ретроингибирование - снижение скорости синтеза нуклеотидов при достижении их достаточной концентрации в клетки за счет аллостерического ингибирования ключевых ферментов.
Если в клетке много пуриновых и пиримидиновых нуклеотидов, то тогда по принципу ретроингибирования ингибируется 2.
Если АМФ синтезировано больше чем ГМФ соответственно будет ингибироваться 5 и 3 ферменты. Избыточная [ГМФ] ингибирует 3 фермент. Второй путь синтеза пуриновых нуклеотидов.
Протекает из готовых азотистых оснований, полученных при катаболизме, этот путь спасает организм от избытка образования мочевой кислоты.
Генетический дефект этого фермента Е2 приводит к заболеванию: синдром Леша-Нихана (болеют только мужчины): агрессивность, мазохизм.
Синтез пиримидиновых нуклеотидов.
В синтезе пиримидиновых нуклеотидов 6 реакций, 3 фермента, в цитоплазме, итогом синтеза является образование УМФ - предшественник остальных нуклеотидов. Регуляторный фермент 1 катализирует 1, 2 и 3 реакции, полифункциональный, называется карбамоилфосфатсинтетаза 2. Дегидрооротат ДГ. Оротатфосфорибозилтрансфераза 5 Оротатфосфорибозилдекарбоксилаза.
Регуляция.
Регуляторный фермент активируется АТФ и ГТФ. УТФ и ЦТФ ингибируют синтез.
Глутамин – CO2, H2O à карбомоилфосфат –Aspà карбомоиласпартатà дигдрооротат—NAD+à оротатà ОПФà УМФà УДФà УТФà ЦТФ
Наиболее известным нарушением синтеза пиримидинов является оротатоцидурия -повышенное выделение с мочой продукта неполного синтеза пиримидинов оротата (оротовая кислота).
В результате генетических дефектов ферментов 5 и 6. Кислота накапливается в органах и тканях, увеличивается содержание в моче. Для детей: отставание в развитии, мегалобластическая анемия, «оранжевая кристаллоурия» из-за кристаллов, имеющих оранжевый цвет. Используют для лечения уридин.
Катаболизм.
Катаболизм пиримидиновых нуклеотидов протекает до полного расщепления пиримидиновых колец. Не имеет специфических конечных продуктов обмена. Конечными продуктами цитозина являются СО2 , NH3 и β-аланин; урацила - NH3 ; тимина - β -аминоизобутират.
Катаболизм пуриновых нуклеотидов.
Включает реакции гидролитического расщепления аминогруппы, рибозного остатка, приводит к образованию ксантина à мочевая кислота. При этом пуриновое кольцо не разрушается. Норма- 0,15-0,47ммоль/л мочевой кислоты. Увел. [мочевой кислоты] - гиперурикемия.
Одним из следствий гиперуркемии является подагра. В основе лежит увеличенное образование мочевой кислоты. Соли - ураты откладываются в суставах.
диетическая перегрузка, т.к. более 50% РНК и более 20% пуринов ДНК,
употребленной пищи, оказывается в моче в виде уратов.
Избыток пуринов продуктов питания.
2. наследственный дефицит фермента №2 «пути спасения».
3. высокая активность ФРПФ-синтетазы
4. ускоренный уровень распада и метаболизма пуриновых оснований
5. уменьшение концентрации в плазме уратсвязывающего белка
При лечении подагры используются «Аллопуринол» он ингибирует фермент катаболизма пуриновых нуклеотидов, ксантиноксидазу и тем самым снижает образование мочевой кислоты. Катаболизм протекает в печени.

Биосинтез дезоксирибонуклеотидов.
Дезоксирибонуклеотиды образуются из соответствующих рибонуклеозидифосфатов путем восстановления ОН-группы во 2 положении рибозы. Нуклеотиддифосфаты образуются из соответствующих нуклеозидмонофосфатов при участии нуклеотидкиназ и с участием АТФ.
Биосинтез осуществляет несколько белков:
Первый фермент - рибонуклеозидредуктазы - катализирует восстановление рибозы в составе нуклеозиддифосфата. Донором водорода является белок №2 - тиоредоксин. Третий фермент - тиоредоксинредуктаза восстанавливает окисленный тиоредоксин за счет водорода НАДФН+Н+из ПФП)
Фермент №1 - регуляторный. Ингибируется дезоксиаденозинтрифосфорной кислотой (дАТФ).
Тимидиловый нуклеотид синтезируется особо, так как нет предшественника -соответствующего рибонуклеотида. Синтезируется из дезоксиуридиндифосфата (дУДФ).
:
Схема:
| тмт |
 дУДФ
дУДФ
На ингибировании дегидрофолатредуктазы основано действие метатриксана аминоптерина (противоопухолевых препаратов). Они тормозят образование ТМФ для ДНК —* тормозится репликация —► тормозится деление опухолевых клеток. Аналогичным действием обладает фторофур.
Регуляция обмена веществ. Гормоны (химические посредники).
План:
1. Виды коммуникации между клетками. Понятие о гормонах, клетках-мишенях и
рецепторах.
2. Классификация гормонов.
3. Синтез и секреция гормонов.
4. Механизм действия гормонов.
У человека существует 2 типа связи между тканями всех типов:
1. быстрая передача электрохимических сигналов нервной системы,
2. при помощи специальных веществ, выделяемых в кровь специализированными
тканями.
Существует несколько типов взаимодействия между клетками или тканями.
Если клетка выделяет биологически активные вещества, которые действуют на эту же
клетку - это аутокринная регуляция.
Если выделяемое вещество действует на соседние клетки, то это паракринная регуляция.
(Например, при воспалительных реакциях выделяются простогландины).
Если молекула биологически активного вещества выделяется в кровь и поступает к
тканям-мишеням - это способ функционирования эндокринной системы.
Если биологически активное вещество выделяется в кровь нервными клетками - это
способ функционирования нейроэндокринной системы.
Существуют специальные железы, секретирующие биологически активные вещества.
Гормоны - это биологически активные вещества, выделяемые специальными
эндокринными железами в ответ на специфические стимулы, которые секретируются в
кровь и доставляются к тканям-мишеням, которые имеют специфические белковые
молекулы-рецепторы к данному гормону, а рецепторы передают сигнал от первичного
посредника или гормона внутрь клетки.
Эндокринная железа секретирует небольшое количество гормона, которое разносится по
всему телу, но действует избирательно только на ткани-мишени.
Присоединение гормона к рецептору запускает каскад ферментативных реакций,
усиливающих эффект гормона (взаимодействуют 1 на 1 - 1с; в результате генерируются
сотни, тысячи реакций).
Классификация гормонов.
1. По химической структуре:
1) производные аминокислот,
2) стероидной природы,
3) пептидной или белковой природы,
4) простогландины (гормоны «местного действия» - производные арахидоновой
кислоты)
2. По механизму действия;
1)гормоны, имеющие рецепторы внутри клетки, то есть в цитоплазме или ядре - это
липофильные гормоны, легко проникают через мембрану, связываются со своими
рецепторами.
Гормон - рецепторный комплекс диффундирует в ядро, взаимодействует с хромотином и стимулирует синтез проматричной РНК, влияя на транскрипцию —> изменяет синтез белков (ферментов). Стероидные (рецепторы в цитоплазме), тиреоидные (тироксин) (рецепторы в ядре).
2) большинство имеют рецепторы на поверхности мембран, в клетку не проникают.
Гормоны передают сигнал внутрь клетки-мишени путем вторичного посредника.
Конечный эффект действия - изменение активности имеющихся ферментов путем
фосфорилирования и дефосфорилирования.
Вторичные посредники бывают: цАМФ, цГМФ, ионы Са1* фосфолипиды мембран.
3. По влиянию на организм:
1) гормоны, регулирующие обмен белков, жиров и углеводов: инсулин, глюкагон,
адреналин и кортикостероиды.
2) гормоны, регулирующие водно-солевой обмен: минералокортикоиды, альдостерон,
АДГ-вазопресин, предсердный Na-уретический пептид.
3) регулирующие обмен Са и Р: паратгормон, кальцитонин, витамин ДЗ гормон или
кальцитриол.
4) регулирующие обмен веществ, связанный с репродуктивной функцией (половые).
5) тропные гормоны, регулирующие деятельность эндокринных желез и выработку
в них гормонов.
6) тиреоидные гормоны, регулирующие основной обмен веществ.
Синтез и секреция гормонов.
Секреторная активность эндокринных тканей регулируется по принципу обратных отрицательных связей.
В клетке гормон, как правило, синтезируется в одной части и секретируется в противоположной. Особенности синтеза и упаковки гормона зависят от химической природы.
Белково-пептидные гормоны после синтеза упаковываются в секреторные гранулы и хранятся в них до поступления в них определенных сигналов (например, глюкагон). Белково-пептидные гормоны синтезируются на полирибосомах гранулярного эндоплазматического ретикулума, в котором и накапливаются. Из него поступают в свободные от полисом участки, которые называются переходными элементами, где от мембраны ЭПР отпочковываются пузырьки, содержащие продукты секреции. Эти пузырьки мигрируют к комплексу Гольджи, который на внутренней поверхности мембраны содержит ферменты, которые подвергают белки химической модификации (например, у инсулина вырезается фрагмент ГШЦ, в результате чего синтезированный прогормон активируется).
Далее из будущих секреторных пузырьков осмотическим путем удаляется вода —*
концентрация белка в гормоне увеличивается в 20-30 раз, образуются зрелые
секреторные пузырьки, они подходят к ЦМ и остаются здесь до поступления сигнала,
под действием которого содержимое пузырьков высвобождается экзоцитозом. Гормон
удерживается в гранулах разными способами. Гормоны с большой молекулярной массой
(белковые) удерживаются благодаря размерам.
Гормоны небольшой молекулярной массы удерживаются в секреторных пузырьках
благодаря соединению с другими веществами (например, окситацин и АДГ
удерживаются нейрофизином 1 и 2).
Стероидные гормоны синтезируются в диффузной молекулярной форме, т.е. не
упакованные сразу же после их синтеза.
Гормоны щитовидной железы могут храниться в фолликулах месяцами.
Поступив в кровоток и осуществив свой эффект, гормоны разрушаются, как правило, в
печени.
Гидрофобные гормоны (стероидной природы или гормоны щитовидной железы)
переносятся кровью в комплексе с транспортными белками и до отделения от белка
остаются неактивными.
Механизм действия гормонов
белково-пептидной природы через вторичных посредников.
Согласно гипотезе молекула гормона взаимодействует со специфическим рецептором, выступающим на поверхности (ЦМ) клетки-мишени - это вызывает конформационные изменения рецептора, что приводит к аллостерической активации фермента -аденилатциклазы (АЦ), который катализирует образование вторичного посредника цАМФ. В ответ на взаимодействие одной молекулы гормона с рецептором синтезируются сотни молекул вторичных посредников — цАМФ, т.е. происходит усиление сигнала от гормона. Каскад с цАМФ
Сигнал от первого посредника (гормона) передается через мембрану внутрь клетки посредством трех встроенных в мембрану белков: рецептора, G-белка, аденилатциклазы (АЦ) (аллостерический фермент, активный центр обращен в цитоплазму). G-белок - его активность зависит от ГТФ.
Гормон взаимодействует с рецептором на поверхности мембраны, образуя гормон -рецепторный комплекс. Сигнал от Г-Р комплекса передается на G-белок, в результате чего он отсоединяет от себя ГДФ и присоединяет ГТФ, он активируется. Может активировать другой мембранно-встроенный белок аденилатциклазу. G-белок активен до тех пор пока не произойдет гидролиз ГТФ, после этого он инактивируется и прекращает активность АЦ. —» его функция: преобразование и передача сигнала от гормона. Существует 2 типа G-белка:
1. активизирующий АЦ;
2. ингибирующий АЦ.
Активированная аденилатциклаза катализирует реакцию образования цАТФ из большого количества АТФ. Реакция идет с высокой скоростью, благодаря значительному снижению свободной энергии, поскольку АТФ превращается в бедную энергией цАМФ. Причем цАМФ образуется сотни.
Таким образом, произошло первое усиление сигнала. На каждую молекулу гормона вырабатывается сотни цАМФ (второго посредника).
В цитоплазме находится белок цАМФ - зависимая или акиназа, активность которой зависит от присутствия второго посредника. Она состоит из двух субъединиц: регуляторной и каталитической, которые соединены вместе. Не обладает ферментативной активностью.
При взаимодействии цАМФ с регуляторной субъединицей происходит отсоединение каталитической субъединицы, она меняет свою конформацию и активируется; приобретает способность фосфорилировать или дефосфорилировать белки (ферменты, ионные каналы) за счет концевой фосфатной группы АТФ. Акиназа обеспечивает второе усиление сигнала, т.к. фосфорилирует несколько белков. После активации акиназы избыток цАМФ разрушается под действием фермента фосфодиэстеразы до АМФ. цАМФ—► АМФ
Эффекты, осуществляемые через ц АМФ.
1. через цАМФ гипоталамические либерины (рилизинг-факторы) действуют на
секреторный ответ аденогипофиза: АКТГ, ФСГ, ТТГ
2. через цАМФ увеличивается проницаемость для воды в собирательных трубочках
под действием АДГ.
3. через цАМФ происходит мобилизация и депонирование жиров, распад гликогена,
изменяется функционирование ионных каналов в постсинаптических мембранах.
цГМФ - присутствует в клетках в меньшем количестве. цГМФ образуется аналогично см. предыдущий каскад. ГЦ - гуанилатциклаза.
цГМФ вызывает эффекты противоположные цАМФ. Например, в сердечной мышце адреналин стимулирует образование цАМФ, ацетилхолин - цГМФ, т.е. оказывают противоположные действия. Адреналин увеличивает силу и частоту сердечных сокращений. Активность цГМФ зависит от присутствия ионов Са. Через цГМФ действует Na-уретический пептид. Также оксид азота NO, который находится в эндотелии капилляров и способен релаксировать (расслаблять их через цГМФ)
Кальций как вторичный посредник.
Действие Са как второго посредника связано с повышением концентрации Са2+ цитоплазме. Концентрация Са может увеличиваться двумя способами:
1. из внутриклеточных депо, например, саркоплазматический ретикулум
2. поступление Са внутрь через управляемые мембранные каналы.
Из внутриклеточных депо Са может высвобождаться под действием инозитол-3-фосфата и в ответ на деполяризацию мембраны, т.е. электрическим стимулом кратковременно открываются кальциевые потенциалзависимые каналы. В некоторых тканях, например, в сердечной мышце число каналов изменяется в результате фосфорилирования белков мембранных каналов цАМФ - зависимой протеинкиназой. Кальциевые каналы активируются химическим способом. Пример, в печени и в слюнных железах приток Са наблюдается при активации а-адренергических рецепторов адреналина. Большая часть Са связывается с белками, небольшая часть находится в ионизированной форме. В клетке существуют специфические белки, такие как кальмодулин или гуанилатциклаза. Они обладают особенностями:
1. у них есть специфические участки связывания с ионами Са, обладающие высоким сродством к Са (даже при низких концентрациях Са)
2. при взаимодействии с Са2+ они меняют свою конформацию, могут активироваться и вызывать различные аллостерические эффекты.
Каскад - это цепь биохимических реакций, приводящих к усилению первоначального сигнала.
Специфические кальциевые каналы плазматической мембраны или ЭПР активируются различными стимулами. В результате ионы Са1+—> внутрь по градиенту —> [Са] увеличивается до 10- 10 моль. Повышение Са активирует несколько путей внутриклеточной регуляции:
1. Са взаимодействует с кальмодулином, затем происходит активация Са -
кальмодулинзависимой протеинкиназы. Она переводит белки из неактивного в
активное состояние, что приводит к различным клеточным ответам. Пример: в
гладких мышечных волокнах может фосфорилировать легкие цепи головки
миозина, в результате чего она присоединяется к актину, возникает сокращение.
2. Са может активировать мембранную гуанилатциклазу и способствовать
выработке второго посредника цГМФ
3. ионы Са могут активировать С-киназу, тропонин С в поперечно-полосатых
мышцах и другие Са-зависимые белки (глицерол - 3 - фосфатДГ)(гликолиз),
пируваткиназа (гликолиз); пируваткарбоксилаза (глюконеогенез)
Мембранные липиды в роли вторичных посредников. Общие черты с предыдущими:
1. присутствует G-белок;
2. присутствует фермент, усиливающий сигнал.
Особенность: фосфолипидный компонент мембраны сам служит фосфорилированным
предшественником для образования молекул-посредников. Этот предшественник
находится в основном на внутренней половине билипидного слоя и называется
фосфатидилинозитол-4,5-бифосфат.
Гормон взаимодействует с рецептором, образовавшийся ГР-комплекс, влияет на G-белок,
способствуя его связыванию с ГТФ. G-белок активируется и может активировать
фосфолипазу, катализирующую гидролиз фосфатидилинозитол-4,5-бифосфат на вторых
посредника: диацилглицерол (ДАТ) и инозитол-3-фосфат.
Диацилглицерол-гидрофобный, может перемещаться путем латеральной диффузии и
активировать мембранносвязанную С-киназу, для этого рядом должен находиться
фосфатидилсерин. С-киназа способна фосфорилировать белки, переводя их из
неактивного в активное состояние. ИФЗ растворим в воде —> цитоплазма, здесь он
стимулирует высвобождение Са из внутриклеточных депо, т. е. ИФЗ высвобождает
третьего посредника ионов Са.
См. Са - как второй посредник.
Ионы Са активируют С-киназу, способствуя ее связыванию с мембраной.
Вне связывания с мембраной она неактивна.
Эффекты действия:
- АКТГ в коре надпочечников через ИФЗ,
- ангиотензин II
- ЛГ в яичниках и клетках Лейдига.
БИОХИМИЯ ПЕЧЕНИ
План:
1 .Роль печени в обмене белков, жиров и углеводов (самостоятельно)
2.Обезвреживающая функция печени
а) микросомальное окисление
б) конъюгация с глюкуроновой и серной кислотой
3.Катаболизм тема, образование желчных пигментов
Обезвреживающая функция печени
1) синтезирование вещества, используемого в других органах: белки плазмы,
глюкоза, кетоновые тела, жиры, холестерин.
2) биосинтез мочевины как конечного продукта азотистого обмена.
3) пищеварительная, синтез желчных кислот, образование и секреция желчи.
4) выделительная. Выделение продуктов обмена веществ через желчь в кишечник.
5) обезвреживание токсических веществ как собственных, так и поступающих
извне - ксенобиотиков (вещества, поступающие в организм и не используемые ни
в энергетических, ни в пластических целях).
Обезвреживание веществ
Если токсическое вещество гидрофобное, то обезвреживание протекает в две стадии. Если гидрофильное, то в одну (во вторую).
1. химическое изменение гидрофобных веществ, в результате они становятся
гидрофильными (окисление, восстановление, гидролиз). Образуются ОН-, СООН,
NH2 - группы.
2. к гидрофильным группам присоединяются различные вещества, в результате
вещества становятся парными и нетоксическими.
1 фаза протекает в микросомах печени (это глыбки эндоплазматической сети),
содержащих системы переноса электронов, которые используют молекулярный
кислород для окисления органических молекул путем присоединения одного или
обоих атомов кислорода к субстрату.
Системы, осуществляющие присоединение обоих атомов кислорода, называются
диоксигеназы (расщепляют гидроксилированные ароматические кольца).
Системы, осуществляющие присоединение одного атома кислорода, называются
монооксигеназы, гидроксилазы.
Второй атом кислорода используется преимущественно для окисления НАДФН до воды. Монооксигеназы находятся в коре надпочечников, семенниках, яичниках,плаценте, где они участвуют в биосинтезе стероидных гормонов (на внутренней мембране митохондрий).
Оксигеназы и гидроксилазы функционируют вместе с флавопротеидами,
цитохромами, отличными от цитохромов ЦПЭ, и объединяются в короткие цепи
переноса электронов.
Отличие этих цепей от ЦПЭ
В отличие от ЦПЭ микросомальные цепи используют кислород в пластических целях и осуществляют гидроксилирование.
+
Лучше всего изучена цепь гидроксилирования неполярных веществ: она включает в себя цитохром Р45о и белок, содержащий негемовое железо (в надпочечниках он называется адренодоксин).
В результате гидроксилирования токсическое вещество становится более полярным, лучше растворяется в воде и подвергается дальнейшим превращениям.
2 фаза: реакции конъюгации (наиболее распространены реакции с глюкуроновой и серной кислотой).
Донор глюкуроновой кислоты - УДФ-глюкуронат (активная форма глюкуроновой кислоты, глюкуроновая кислота — это производное глюкозы, окисленной по
 спиртовой группе. Фермент - УДФ-глюкуронилтрансфераза).
спиртовой группе. Фермент - УДФ-глюкуронилтрансфераза).
| + Н2О + НАДФ |
бензол+О2+НАДФН+Н+
фенол (токсическое, но полярное, может
подвергаться следующим преобразованиям)

|
В печени:
Фенол
+ УДФ-глюкуронат à
нетоксическое, парное, выводится из
организмна
Подобным образом обезвреживаются лекарственные вещества после оказания ими
действия.
Пример: фенобарбитал - снотворное и обезболивающее, подвергается
гидроксилированию монооксигеназой, последующей конъюгацией с
глюкуроновой кислотой.
Аспирин выводится из организма после конъюгации с глюкуроновой кислотой
или глицином. Кроме чужеродных веществ обезвреживанию подвергаются
продукты собственного катаболизма.
Например, продукты распада гема -простетической группы гемоглобина. До 80%
всего гема находится в гемоглобине, остальная часть в геминовых ферментах,
следовательно, обмен гема отражает состояние обмена гемоглобина.
Продолжительность жизни эритроцитов - 110-120 дней, после этого они
фагоцитируются клетками РЭС (селезенка, печень, красный костный мозг, где они
подвергаются разрушению).
Гем, освободившийся после распада гемоглобина, повторно не используется. Он
распадается на железо и желчные пигменты, они выводятся из организма
(задерживается небольшая часть, а железо с помощью белка плазмы трансферрина
поступает в депо - красный костный мозг).
Деградация гема осуществляется микросомальной гемооксигеназой, в реакции
используется кислород и НАДФН+ЕГ, в результате гем дециклизуется, а железо и
глобиновая часть сохраняется. Оксигеназа специфически расщепляет а-метеновые мостики, при этом метеновый атом углерода окисляется, образуется зеленый вердоглобин. После этого спонтанно отщепляется железо и глобин, образуется биливердин (зеленый). Отщепленная белковая часть подвергается гидролизу до аминокислот, которые используются повторно. Биливердин под действием фермента НАДФН-зависимой биливердинредуктазы восстанавливается до билирубина (желтый). Образование билирубина можно проследить на синяке. Билирубин транспортируется в РЭС в комплексе с альбумином, затем в печень, где он обезвреживается путем конъюгации с двумя молекулами глюкуроновой кислоты с образованием диглюкуронида билирубина под действием УДФ-глюкуронилтрансферазы.
Болезни, связанные с наследственными изменениями фермента
УДФ-глюкуронилтрансферазы
1. желтуха - синдром Криглера - Найара - генетическое изменение фермента
УДФ-глюкуронилтрансферазы приводит к гибели в течение первого года жизни-
нарушение конъюгации билирубина.
2. хроническая желтуха - синдром Джонсона — нарушение конъюгации
билирубина со второй молекулой глюкуроновой кислоты, следовательно,
нарушается секреция желчи.
Стр. 507
Образовавшийся диглюкуронидбилирубин не токсичен --------------------------------------- ► желчь -------------- ►
кишечник. В кишечнике конъюгаты билирубина гидролизуются р-глюкуронидазой (фермент бактерий), в результате отщепляется глюкуроновая кислота. Образовавшийся билирубин восстанавливается по метеновым мостикам с образованием стеркобилиногенов и уробилиногенов. Небольшая часть уробилиногена идет в кровь, затем в печень, где расщепляется до ди- и трипирролов. Основная часть уробилиногена и стеркобилиногена выводится с калом, частично почками. Они бесцветные, а в кале и в выпавшей моче окисляются кислородом до уробилина и стеркобилина, имеющих желтый цвет. Продукты превращения билирубина называются желчными пигментами. Желчные пигменты являются компонентами желчных камней. Концентрация билирубина в крови - 8-20 мкмоль/л.
Определение концентрации желчных пигментов в крови и моче применяется для диагностики желтух, определяется прямой (конъюгированный с глюкуроновой кислотой) и непрямой (неконъюгированный) билирубин.
Желтуха - это накопление желчных пигментов в плазме крови в количествах достаточных, чтобы придать желтую окраску коже и конъюктиве.
| Название желтухи | Причины возникновения | Биохимические показатели продуктов обмена билирубина | ||
| кровь | Моча | кал | ||
| 1. гемолитическая | Усиленный распад ЭЦ со скоростью, превышающей способность печени улавливать билирубин из циркуляции (из крови). | ↑непря-мого билирубина | ↑уроби-лина | ↑уроби-лина и стеркоби- лина |
| 2. паренхиматозная или печеночно-клеточная | Повреждение клеток печени вирусами, токсическими гепатотропными соединениями (гепатит, цирроз). Нарушается способность образовывать конъюгаты билирубина и секретировать их в желчь. | ↑прямого и непрямого билирубина | Появление прямого билирубина ↓уробилина | ↓↑выделения стеркобилина фекалии светлые |
| З.обтурацион-ная или механическая | Механическое нарушение оттока желчи в кишечник | ↑↑прямого и непрямого билирубина | ↑↑прямого билирубина | Отсутствие Желчных пигментов, цвет глины |
Желтуха у новорожденных: у плода и новорожденных количество ЭЦ в расчете на единицу массы больше, чем у взрослых, больше концентрация гемоглобина в ЭЦ. В течение нескольких недель после рождения количество гемоглобина в крови приближается к таковому у взрослых. Скорость распада ЭЦ выше, чем в последующее время, а способность печени удалять билирубин выражена еще слабо, поэтому в первые недели жизни концентрация билирубина высокая.
БИОХИМИЯ КРОВИ
Кровь- ткань, клетки которой циркулируют в замкнутой системе сосудов. Кровь и лимфа - сформировавшиеся эволюционно совершенные формы коммуникации. Они облегчают контакты с внешней средой и между тканями организма. Фундаментальная роль - поддержание гомеостаза. В медицинской практике кровь - важнейший объект для биохимических исследований.
Основные биохимические и физиологические функции крови:
1. дыхательная (транспорт О2 от легких к тканям, транспорт СО2)
2. питательная (транспорт поглощенных питательных, минеральных,
биологически активных веществ)
3. транспорт экзогенных метаболитов, регуляция метаболизма
4. доставка конечных продуктов обмена веществ в почки, кожу, кишечник для
элиминации
5. поддержание в организме нормального кислотно-щелочного равновесия
6. обеспечение постоянства концентрации Н+ или постоянства рН, который
является основным фактором регуляции ферментативной активности
7. распределение тепловой энергии с целью поддержания нормальной
температуры тела
8. иммунная защита (лейкоциты и антитела).
Белки плазмы крови
Концентрация белков плазмы у взрослых людей - 57-81 г/л (СИ).
Белки плазмы - это сложная смесь, которая включает простые белки, а также
различные сложные конъюгированные молекулы (гликопротеины,
фосфопротеины).
Основными методами разделения смеси на индивидуальные белки являются
использование растворителей/электролитов. В результате удается выделить 3
основные группы белков плазмы:
1. фибриноген
2. альбумин
3. глобулин
Наиболее простым и удобным методом разделения белков является электрофорез:
1. на бумаге удается получить 5 фракций
- альбумин
- α1-глобулин
- α2-глобулин
- β-глобулин
- γ-глобулин
2. в крахмальном геле и иммуноэлектрофорез позволяют разделить белки плазмы
на большее количество фракций (9-13)
Электрофоретический анализ белков представляет ценность при постановке диагноза-»планировка лечения. Например, при множественной миеломе резко повышается концентрация глобулинов класса А. При нефрозе снижается общий белок и альбумины, повышаются α1 и α2- глобулины. При циррозе печени уменшается общий белок и альбумины, увел. у-глобулины. При хроническом ревматоидном артрите увел. β- и у-глобулины.
Сывороточный альбумин
Синтезируется в печени и его единственная ППЦ состоит из 610 аминокислот и имеет 17 S-S связей. Это один из немногих белков плазмы, который не является гликопротеином. Имеет наименьшую молекулярную массу и наиболее подвижен при электрофорезе. Наиболее важной функцией является то, что этот белок вносит наиболее существенный вклад во внутрисосудистое осмотическое давление (75-80%). При гипоальбуминемии (заболевание печени и почек)—> отек мягких тканей.
Шок, как и отек, часто встречающийся клинический синдром. При травмах и после тяжелых операций капилляры становятся проницаемыми для белков плазмы, они выходят в межклеточное пространство —> много жидкости с
альбумином —> умен. объем крови, поступление ферритина из печени, -умен. АД, гипоксия. Выздоровление часто не наступает при введении жидкости -необратимый шок.
Кроме участия в поддержании осмотического давления альбумин является молекулой - переносчиком. Он транспортирует различные нерастворимые в воде вещества и необходим для нормального обмена жиров. Важна роль в переносе высших жирных кислот из печени в периферические ткани. При нарушении обмена - альбуминемии – умен.- концентрация альбумина, транспорт жирных кислот нарушен, а уровень ЛП увел., холестерина, фосфоглицерола. Альбумин связывает билирубин —> в печень. Концентрация Са2+ в плазме, стероидных гормонов и триптофана регулируется в определенной степени в результате их связывания с альбумином. Многие лекарства (пеницилин,аспирин) образуют прочные комплексы с альбумином.
Глобулины
Гетерогенная сложная смесь белков, нерастворимых в воде. По химической природе они гликопротеины.
α-глобулины
Наиболее изучены функции:
1. ретинолсвязывающий белок (транспорт ретинола) образует эквимолярный
комплекс с преальбумином, который функционирует одновременно как Туг-
связывающий белок. Образование комплекса имеет биологический смысл-
предотвращение экскреции почками ретинолсвязывающего белка.
2. α2 - глобулин (церуллоплазмин): содержит 0.34% по массе меди. Для
связывания одно- и двухвалентной меди в молекуле имеется δ-участок. Будучи
медиатором транспорта меди поддерживает ее нормальный уровень в тканях
(печени).
Доказана ферроксидазная и полиаминооксидазная активность глобулина. У
больных с наследственной болезнью Вильсона уровень церуллоплазмина умен., при этом концентрация свободной меди увел. (особенно в печени и мозге)-»неврологические расстройства и поражения печени. Аналогично при хронических и острых отравлениях медью.
3. гаптоглобин составляет 1/4 всех α2 - глобулинов. Образует специфические
стабильные комплексы с гемоглобином (1:1). В организме такие комплексы могут
образоваться в результате внутрисосудистого гемолиза эритроцитов.
Биохимический смысл - высокая молекулярная масса, которая препятствует
экскреции белков с почками и защита самих почек от повреждения их
гемоглобином. Снижается концентрация гаптоглобина у больных с
гемолитической анемией.
β-глобулины
Фракция включает различные белки, в том числе липопротеины. Главный компонент - трансферрин, Мг=77500, ИЭТ=5.5. Этот белок составляет «3% от всех белков плазмы. Функция: связывание и транспорт Fe3+ в различные ткани (в РЭС). Может взаимодействовать с Си и Zn .Осуществляет регуляцию свободного железа в плазме, предотвращает избыточное накопление железа в тканях и потерю его с мочой. Может связывать 2Fe 3+ только в присутствии СО2. У
здоровых людей 1/3 трансферрина насыщена Fe3 +. При беременности, у больных с дефицитом железа – увел. концентрация трансферрина в плазме.
γ - глобулины
Иммуноглобулины, синтезированные Вл или плазмоцитами. Антите