Изменение энтропии при нагревании (охлаждении).
Применим уравнение (1) к изобарному процессу (р = const).
Для 1 моль вещества
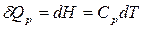 ;
;
 ,
,
где Ср – молярная изобарная теплоемкость вещества, Дж/(моль×K).
Проинтегрируем последнее уравнение в определенных пределах (при изменении температуры от Т1 до Т2):
 . (2)
. (2)
Если в исследуемом температурном интервале теплоемкость мало зависит от температуры, т.е. можно использовать среднюю изобарную теплоемкость  , то решение уравнения (2) имеет вид:
, то решение уравнения (2) имеет вид:
 . (3)
. (3)
Изменение энтропии в ходе химической реакции (при Т = const).
Так как энтропия – функция состояния, то ее изменение в ходе химической реакции можно рассчитать по уравнению:
 , (4)
, (4)
где Sj, Si – энтропии продуктов реакции и исходных веществ соответственно при температуре реакции; nj, ni – стехиометрические коэффициенты.
В справочной литературе приведены стандартные энтропии веществ при температуре 298 К.
Если реакция протекает при температуре, отличной от 298 К, то энтропию вещества рассчитывают по уравнению (3), приняв для удобства за Т1 температуру 298, а за Т2 – температуру реакции:
 , (5)
, (5)
где DS – изменение энтропии вещества при нагревании (или охлаждении) вещества от 298 К до температуры Т.
После подстановки (5) в формулу (4) для каждого участника реакции получим формулу для расчета изменения энтропии в ходе реакции, протекающей при температуре Т:
 ,
,
где  – разность между изобарными теплоемкостями продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
– разность между изобарными теплоемкостями продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.