Взаимодействие с водородом и химические свойства галогеноводородов.
1.H2 + F2 ® 2HF (со взрывом) CaF2 + H2SO4(конц.) ® CaSO4 + 2HF
H2 + Cl2 ® 2HCl
Растворимость в воде. Благодаря высокой полярности газообразные НХ хорошо растворимы в воде * ) , например, в 1 объеме воды при 0оС растворяется 507 объемов HCl или 612 объемов HBr. При охлаждении из водных растворов выделены кристаллические гидраты HF. H2O, HCl. 2H2O и т.д., которые построены из соответствующих галогенидов оксония, например,  .
.
Кислотные свойства. В водных растворах НХ устанавливается протолитическое равновесие
HX + HOH = 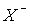 + H3O+ (X = F, Cl, Br, I), (1),
+ H3O+ (X = F, Cl, Br, I), (1),
то есть эти растворы являются кислотами.
В ряду HCl-HBr-HI степень протолиза, то есть сила кислот увеличивается (см.величины рКa в табл.4), что связано с ростом размера аниона 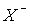 и уменьшением энергии гетеролитического распада НХ(р-р)= Н+(р-р) +
и уменьшением энергии гетеролитического распада НХ(р-р)= Н+(р-р) + 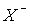 (р-р) ([1], с.291).
(р-р) ([1], с.291).
Водные растворы HCl, HBr и HI ведут себя как сильные кислоты. В разбавленных водных растворах HF является слабой кислотой (рКа = 3.2), что связано с высокой энергией связи H-F по сравнению с энергией связи H-О в молекуле воды. Однако при повышении концентрации HF выше1 М сила кислоты увеличивается. За счет образования водородной связи образуются ионы  : HF +
: HF +  =
= ; К = 3.86 (25оС) и поэтому равновесие (1) смещается вправо.
; К = 3.86 (25оС) и поэтому равновесие (1) смещается вправо.
Особенностью фтороводорода и плавиковой кислоты является способность разъедать стекло:
Na2O. CaO. 6SiO2 + 28HF(газ) = 2NaF + СaF2 + 6SiF4 + 14H2O
Na2O. CaO. 6SiO2 + 36HF(р-р) = Na2SiF6 + CaSiF6 + 4H2SiF6 + 14H2O,
поэтому при работе с ними пользуются посудой, сделанной из тефлона.
Восстановительные свойства галогеноводородов. С увеличением размера и уменьшением энергии ионизации атома галогена восстановительная способность в ряду HF-HCl-HBr-HI увеличивается (табл.5). Например, плавиковая HF и соляная HCl кислоты с концентрированной серной кислотой не взаимодействуют, а HBr и HI ею окисляются:
2HBr + H2SO4(конц) = Br2 + SO2 + 2H2O
8HI + H2SO4(конц) = 4I2 + H2S + 4H2O.
Таблица 5.Стандартные потенциалы (Ео, В)реакции 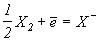 .
.
| F | Cl | Br | I |
| +2.82 | +1.36 | +1.06 | +0.53 |