Защита металлов от коррозии
Зная причину химической и электрохимической коррозии металлов, нетрудно выявить основные методы защиты. Так как причиной электрохимической коррозии является возникновение и работа гальванического элемента, то любое нарушение его функционирования будет предотвращать коррозию.
Все методы защиты условно делятся на следующие группы:
· легирование металлов;
· защитные покрытия (металлические, неметаллические);
· электрохимическая защита (протекторная, катодная);
· изменение свойств коррозионной среды;
· рациональное конструирование изделий.
Выбор способа защиты определяется его эффективностью, а также экономической целесообразностью.
Легирование металлов.Легирование металлов – эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла, т.е. образование на его поверхности защитных плёнок из оксидов легирующих добавок. В качестве таких компонентов применяют хром, никель, вольфрам и т.д.
Защитные покрытия. Слои, искусственно создаваемые на поверхности металлов для предохранения их от коррозии, называются защитными покрытиями. Защитные слои подразделяются на металлические и неметаллические.
Наиболее распространены неметаллические защитные покрытия – эмали, лаки, краски, пластмассы, различные смолы, полимеры. Защитное действие этих покрытий сводится в основном к изоляции металлов от окружающей среды. Достоинство этого способа защиты – простота технологии их нанесения. Недостаток – легко разрушаются из-за хрупкости и растрескивания при тепловых и механических ударах; эти покрытия защищают до тех пор, пока сохраняется их целостность.
Ряд покрытий, получаемых химической обработкой металла, включают защитные покрытия, образующиеся непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных оксидных плёнок в технике называют оксидированием. Некоторые процессы имеют специальное название. Так, процесс нанесения на сталь оксидных плёнок иногда называют воронением, а электрохимическое оксидирование алюминия – анодированием. Оксидные покрытия на стали можно получить при высокой температуре окислением на воздухе или погружением в горячие концентрационные растворы щелочей, содержащих персульфаты, нитраты или хлораты металлов. В сухом воздухе оксидные плёнки достаточно стойки, а во влажном воздухе, воде защитные свойства их крайне невысоки.
Фосфатные покрытия, химически создаваемые на поверхности металлов, сами по себе не обеспечивают достаточной защиты от коррозии. Их используют в основном в качестве подложки под краску, что повышает сцепление лакокрасочного покрытия со сталью и уменьшает коррозию в местах царапин.
Металлические покрытия получают путем осаждения на защищаемой детали тонкого слоя другого металла, более стойкого в условиях эксплуатации, чем защищаемый металл. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные.
К катодным покрытиям относятся покрытия из металлов, потенциалы которых в данной среде имеют большие значения, чем потенциал основного металла. В качестве примеров катодных покрытий на стали можно привести Cu, Ni, Ag, Sn.
Рассмотрим пример катодного покрытия. Белая жесть – железо, покрытое слоем олова (Sn), находится во влажном воздухе (O2 + H2O). При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором защищаемый материал (Fe) служит анодом и растворятся, а материал покрытия (Sn) – катодом, т.к.  <
< .
.
(-) Fe | O2, H2O | Sn (+)
 A: Fe – 2e- = Fe2+ 2
A: Fe – 2e- = Fe2+ 2
K: O2 + 2H2O + 4 = 4OH- 1
= 4OH- 1
2Fe + O2 + 2H2O = 2Fe(OH)2 .
.
Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали:  ;
; 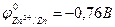 . В этом случае при нарушении целостности покрытия или возникновении пор в среде, имеющей ионную проводимость, основной металл (Fe) будет катодом возникающего коррозионного элемента и не будет корродировать, а разрушению подвергнется цинк:
. В этом случае при нарушении целостности покрытия или возникновении пор в среде, имеющей ионную проводимость, основной металл (Fe) будет катодом возникающего коррозионного элемента и не будет корродировать, а разрушению подвергнется цинк:
(-) Zn | H2O, O2 | Fe (+)
A: Zn – 2e- = Zn2+ окисление
K: O2 + 2H2O + 4 = 4OH- восстановление
= 4OH- восстановление
2Zn + O2 + 2H2O = 2Zn(OH)2.
Цинк будет защищать основной металл пока весь не растворится . Таким образом, анодные покрытия более эффективны, т.к. защищают основные металлические конструкции и при нарушении целостности покрытия.
Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 – катодное, а в растворе органических кислот – анодное.
Для получения металлических защитных покрытий применяются различные способы: электрохимический (электролиз – нанесение гальванических покрытий), погружение в расплавленный металл, металлизация (распыление расплавленного металла с помощью струи сжатого воздуха), термодиффузионный (путём диффузии металла в металл при повышенной температуре), химический (восстановление соединений металла с помощью водорода, гидразина и других восстановителей).
Электрохимическая защита.Электрохимическая защита осуществляется присоединением к защищаемой конструкции металла с меньшим значением электродного потенциала – протектора (протекторная защита) или катодной поляризацией за счёт извне приложенного тока (катодная защита).
Так, если к стальной конструкции присоединить кусок более активного металла, например магния ( ;
; 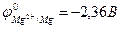 ), то в условиях появления электролита (например, конденсация влаги) защищаемая стальная конструкция будет выполнять функцию катода, а магний (протектор) – функцию анода (протекторная защита).
), то в условиях появления электролита (например, конденсация влаги) защищаемая стальная конструкция будет выполнять функцию катода, а магний (протектор) – функцию анода (протекторная защита).
 Сущность электрохимической катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. В этом случает в среде электролита будет протекать электролиз. Рассмотрим пример электрохимической катодной защиты подземного трубопровода во влажной почве (рис. 10.10).
Сущность электрохимической катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. В этом случает в среде электролита будет протекать электролиз. Рассмотрим пример электрохимической катодной защиты подземного трубопровода во влажной почве (рис. 10.10).
На электродах будут протекать процессы:
A: Fe – 2e- = Fe2+
K: 2H2O + 2e = Н2 + 2OH
Fe + 2H2O = Fe2+ + H2 + 2OH = Fe(OH)2¯ + H2.
= Fe(OH)2¯ + H2.
Вспомогательный электрод (анод) растворяется, на защищаемом трубопроводе (катоде) выделяется водород.
Катодную защиту используют для защиты от коррозии подземных и морских трубопроводов, кабелей, водных резервуаров, подводных лодок, оборудования химических заводов.
Изменение свойств коррозионной среды. Здесь применяется специальная обработка электролита или среды, в которой находится защищаемая конструкция. Вода, поступающая в котельные установки, подвергается деаэрации – удалению растворённого воздуха. Введение в электролит ингибиторов, их адсорбция на защищаемой детали резко замедляет процесс коррозии.
В последние годы широко применяют летучие парофазные игибиторы. Их используют для защиты машин, аппаратов и других металлических изделий во время их эксплуатации в воздушной атмосфере, при перевозке и хранении. Летучие ингибиторы вводятся в контейнеры, в упаковочные материалы или помещаются в непосредственной близости от рабочего агрегата. Благодаря достаточно высокому давлению паров летучие ингибиторы достигают границы раздела металл – воздух и растворяются в плёнке влаги, покрывающей металл. Далее они адсорбируются на поверхности металла.
Рациональное конструирование изделий. Рациональное конструирование изделий должно исключать наличие или сокращать число и размеры особо опасных с точки зрения коррозии участков в изделиях или конструкциях (сварных швов, узких щелей, контактов разнородных по электродным потенциалам металлов и др.), а также предусматривать специальную защиту металла этих участков от коррозии.
Контакт с металлами и неметаллами имеет большое значение для оценки опасности коррозии. В частности, при конструировании следует учитывать опасность контактной коррозии, в связи с чем нельзя без соответствующей изоляции соприкасающихся поверхностей сочетать в конструкции металлы, существенно отличающиеся по величине потенциала. Важно учитывать использование в конструкции различных неметаллических материалов, в том числе теплоизоляционных, электроизоляционных и др. Известно, что некоторые из этих материалов, например войлок, асбест, древесина, могут впитывать и удерживать влагу и, таким образом, быть очагами усиленной коррозии.
Скопление влаги в различных элементах конструкции способствует развитию коррозии. Поэтому при создании различных конструкций предусматривают возможность проветривания полостей, наличие дренажных отверстий и др. Исключительно опасно в коррозионном отношении наличие щелей и зазоров. На изделии не должно быть различных углублений, канавок и пазов, в которых может скапливаться влага. Элементы конструкции должны быть по возможности обтекаемыми; это облегчает испарение влаги.