С-алкилирование аренов
Процессы алкилирования
Ядовитые растения (Хвощи пестрый, полевой)
Сорняки.
Плауны см слайд
Хвощи
1. Входят в состав первичных растительных сообществ.
2. Ископаемые хвощевидные участвовали в образовании каменного угля.
3. Лекарственные растения (кровоостанавли-вающее средство) – Хвощ полевой, Хвощ зимующий.
4. Красильные растения (корневища) – Хвощи луговой и полевой (серо-желтый цвет).
5. Кормовые растения – Хвощ лесной, Хвощ приречный.
6. Для полирования столярных изделий.
7. Декоративные растения – Хвощ лесной.
В связи с высоким содержанием в побегах кремнезема спорофиты хвощей в прошлом часто использовались как своего рода жесткие мочалки для чистки посуды.
Летние побеги хвощей используются как мочегонное средство. Хвощ полевой – злостный сорняк. Хвощ болотный ядовит
Алкилирование- процесс замещения атома водорода или металла в молекуле субстрата на алкил. Различают С-, N- и О-алкилирование. Если в молекулу вводится арил, реакция называется арилированием.
В качестве алкилирующих агентовиспользуют главным образом, галогенпроизводные, непредельные соединения, спирты и эфиры серной и сульфокислот.
Алкилирование используется для построения углеродного скелета молекулы, а также защиты функциональных групп (гидроксильной или аминогруппы).
С-Алкилирование аренов можно проводить по Вюрцу-Фиттигу, Вюрцу-Гриньяру и т.д., но в промышленности чаще всего используется реакция Фриделя –Крафтса:
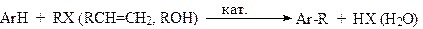
В качестве алкилирующих агентов применяют в основном алкилгалогениды, алкены и спирты.
1.Механизм реакции- обратимое электрофильное замещение(SE).
Скорость реакцииопределяется устойчивостью s-комплекса а также концентрацией реагирующих веществ и катализатором.
Направление реакции в связи с её обратимостью зависит от условий её проведения: 1) в мягких условиях определяется устойчивостью s-комплекса (кинетический контроль) и выполняются правила ориентации. 2) в жестких условиях (значительные температура, длительность процесса, количества катализатора) - определяется устойчивостью конечных продуктов (термодинамический контроль реакции) и правила ориентации не выполняются. Например, при метилировании толуола метилхлоридом при 0°С образуется 27% м-ксилола, при 55° - 87%, а при 106°С – 98%.

2. Основные недостаткиреакции Фриделя-Крафтса:
1) Полиалкилирование,что объясняется большей реакционной способностью продуктов алкилирования, чем исходного субстрата.

2) Изомеризация радикала, которая вызвана превращением образующегося карбкатиона в более стабильный. Например:

3) Изомеризация продуктареакции, которая вызвана обратимостью реакции. Например: При нагревании п-ксилола с хлористым водородом и AlCl3, большая часть углеводорода превращается в термодинамически более устойчивый м-ксилол:
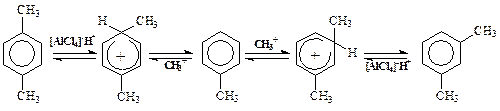
При этом в ряде случаев добавление веществ, связывающих галогеноводород, предотвращает обратимость реакции.
4) Диспропорционирование алкиларенов. Одновременно может происходить и изомеризация перемещающейся группы:

Изомеризация и диспропорционирование конечного продукта в кислой средеможет служить доказательством обратимости процесса алкилирования.
3. Катализаторы в процессах алкилирования:
1. Протонные кислоты- их активностькак катализаторов не зависит от Кдис. и падает в ряду HF > H2SO4 > H3PO4.
2. Апротонные кислоты(кислоты Льюиса) - по активности их можно расположить в следующий ряд: AlBr3 > AlCl3 > FeCl3 > ZnCl2
3. Оксиды металлов и бора (B2O3). Наиболее активными оказались амфотерные оксиды (Al2O3, Cr2O3 и др.), модифицированные BF3.
4. Цеолиты, общей формулы M2/nО.Al2O3.xSiO2.yH2O, где М – металл; n – его валентность.
5. Катиониты,представляющие собой полимеры (чаще всего полистирольные), содержащие –SO3H, -COOH, -PO3H2 и другие группы.
Активность катализатора зависит также и от 1) строения субстрата; 2) природы алкилирующего агента; 3) условий реакции (температура, давление и т.д.). Например, BF3 является активным катализатором при алкилировании спиртами, алкенами, фторпроизводными, но при алкилировании другими алкилгалогенидами его активность мала.