I – сила тока (в амперах),
τ – время электролиза (в секундах),
F – число Фарадея равное 96500 Кл.
Если в реакции окисляются или восстанавливаются газообразные вещества, то в полученное уравнение вместо масс подставляются соответствующие значения объемов.
Пример – рассчитать массу меди, которая выделится на катоде при электролизе раствора сульфата меди в течение 2 часов при силе тока в 100 А.
Решение: Cu2+ + 2e ® Cu, fэкв (Cu) = 1/2.
Подставляя в уравнение соответствующие значения получаем:
m(Cu) = 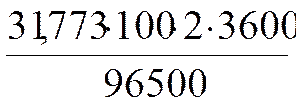 = 237,063 г.
= 237,063 г.
4 Аккумуляторы
Аккумуляторы – устройства позволяющие многократно повторять операции их зарядки и разрядки. Теоретически обратимым, после разрядки, может быть любой гальванический элемент, но восстановленная емкость для большинства гальванических элементов невелика.
Наиболее лучшими эксплуатационными характеристиками обладают следующие аккумуляторы:
1) кислотные – свинцовые,
2) щелочные – никель–кадмиевые, железо–кдмиевые и серебряно–цинковые аккумуляторы.
Разберем химические процессы, протекающие в ходе работы данных аккумуляторов:
1) Свинцовый аккумулятор
Электроды свинцового аккумулятора выполнены в виде ячеистых пластин из свинцового сплава; ячейки заполнены смесью свинцового глета (PbO) с глицерином. После заполнения аккумулятора электролитом (H2SO4) оксид свинца превращается в сульфат. При зарядке протекает электролиз, а при разрядке работает гальванический элемент.
Зарядка аккумулятора – окислительно-восстановительная реакция протекающая принудительно под действием электрического тока. На электродах протекают следующие реакции:
Анод (+): PbSO4 + 2H2O - 2e = PbO2 + SO42– + 4H+ ,
Катод (–): PbSO4 + 2e = Pb + SO42-.
Разрядка аккумулятора – превращение энергии окислительно-восстановительной реакции в электрическую энергию. При замыкании внешней цепи электроны с анода (Pb) переходят на электроды, заполненные PbO2 (катод):
Анод (+): Pb + SO42-- 2e = PbSO4 ,
Катод (–): PbO2 + SO42– + 4H+ + 2e = PbSO4 + 2H2O.
Суммарное уравнение:
разрядка ®
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O, ЭДС = 2,0В.
¬ зарядка
При разрядке аккумулятора расходуется серная кислота и образуется вода с плотность примерно в два раза меньшей, что приводит в свою очередь к уменьшению плотности электролита. На измерении плотности электролита основан один из методов контроля заряда аккумулятора.
К основным преимуществам свинцового аккумулятора относятся большая электрическая емкость и устойчивость в работе при многократных циклах перезарядки. Основные недостатки – массивность и токсичность свинца и его соединений.
2) Кадмиево-никелевый аккумулятор (КН)
разряд ®
Cd + 2NiO(OH) = 2Ni(OH)2 + Cd(OH)2, ЭДС = 1,4 В. ¬ заряд
3) Железо-никелевый аккумулятор (ЖН)
разряд ®
Fе + 2NiO(OH) = 2Ni(OH)2 + Fе(OH)2 , ЭДС = 1,2 В.
¬ заряд
Аккумуляторы КН и ЖН являются щелочными, так как электролитом для них служит раствор гидроксида калия с небольшим количеством LiОН.
В настоящее время проводятся исследования по созданию щелочных аккумуляторов с характеристикам, соответствующими свинцовому аккумулятору.
4) Серебряно-цинковый аккумулятор
разряд ®
AgO + Zn + H2O = Ag + Zn(OH)2 ,ЭДС = 1,85 В.
¬ заряд
Вследствие большой удельной емкости и высокого значения ЭДС эти аккумуляторы чаще всего применяются для питания различных микроэлектронных устройств.
ЛЕКЦИЯ № 11
«КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ»
Коррозия – процесс окисления металла под воздействием окружающей среды. Наибольший вред от коррозии приходится на долю основного конструкционного металла – железа. Безвозвратные потери металлов от коррозии составляют примерно 10–15% мировой продукции стали. Но еще больший вред связан не с потерей металла, а с порчей изделий. Таким образом борьба с коррозией является важной народнохозяйственной задачей.
1 Виды коррозии
По характеру разрушения металла применяется следующая классификация видов коррозии:
1) Равномерная, 2) Пятнами, 3) Точечная,