R – универсальная газовая постоянная,
С — молярная концентрация раствора,
Математически осмос выражается уравнением Вант-Гоффа
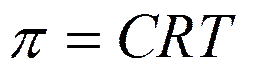 , (4.4)
, (4.4)
где p – осмотическое давление, кПа,
Т – абсолютная температура.
Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры.
Уравнение Вант-Гоффа по форме записи соответствует уравнению состояния идеального газа
 или
или  . (4.5)
. (4.5)
Проведя аналогию можно сказать, что осмотическое давление равно тому давлению которое оказывало бы растворенное вещество, если бы оно находилось в газообразном состоянии и занимало объем равный объему раствора.
Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры. Концентрированные растворы сахара (сироп) и соли (рассол) широко применяются для консервирования продуктов, так как вызывают удаление воды из микроорганизмов.
3 Применение законов Рауля и уравнения Вант-Гоффа к растворам электролитов
При экспериментальной проверке законов Рауля и уравнения Вант-Гоффа оказалось, что для ряда растворов экспериментальные значения были больше теоретических, нередко в несколько раз. Особенностью данных растворов было то, что они проводили электрический ток. Для применения к ним законов неэлектролитов необходимо вводить в соответствующие формулы поправочный, так называемый, изотоническим коэффициентом (i). Изотонического коэффициента показывает, во сколько раз число частиц в растворе (Nобщее) больше того, которое растворили (N0), т.е.
i = Nобщее/N0. (4.6)
Для объяснения данных отклонений Аррениус в 1887 предложил теория электролитической диссоциации. В растворах электролитов происходит самопроизвольный распад – диссоциация молекул на ионы, в результате чего раствор становится электропроводным. Температуры кипения и замерзания растворов, осмотическое давление зависят не только от концентрации электролита, но и от степени его диссоциации (α).
Степень диссоциации – это отношение числа продиссоциировавших (Nдис) частиц к исходному числу частиц растворенного вещества (No)
α = Nдис/No. (4.7)
Для таких сильных электролитов как HCl, Ca(NO3)2, Cr(NO3)3 оказалось, что значения i составляют примерно соответственно 2, 3, 4. Из записи электролитической диссоциации данных соединений видно, что количества образующихся ионов согласуются с приведенными значениями i:
HCl ® H+ + Cl– i = 2,
Ca(NO3)2 ® Ca2+ + 2NO3– i = 3,
Cr(NO3)3 ® Cr3+ + 3NO3– i = 4.
Для слабых электролитов значения i были больше единицы, но не превышали два. Это объясняется частичной диссоциацией слабых электролитов.
Оказалось, что диссоциации подвергаются вещества с ионной, полярной или легко поляризуемой связями.
Важную роль в диссоциации играет растворитель. Одни и те же вещества проявляют свойства сильных электролитов в одних растворителях и слабых – в других. Так, например, в воде хлороводород – сильный электролит, а в бензоле – слабый. Гидроксиды щелочных металлов полностью диссоциируют в воде, но различаются по силе в спиртовых растворах. Чаще всего наибольшая степень диссоциации проявляется в растворителях с большой диэлектрической проницаемостью (ε-эпсилон), высокой сольватирующей способностью и малой вязкостью. К таким растворителям в первую очередь относится вода.
Механизм электролитической диссоциации согласуется со схемой приведенной на рисунке 4.2.
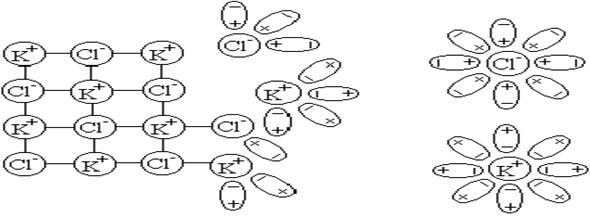
Рисунок 4.2 Схема растворения и диссоциации
хлорида калия
Из данной схемы видно, что продукты диссоциации электролита (ионы) в результате электростатического взаимодействия с растворителем образуют сольваты или в случае воды – гидраты.
ЛЕКЦИЯ № 5
«РАСТВОРЫ ЭЛЕКТРОЛИТОВ»
1 Электролитическая диссоциация
Электролитическая диссоциация – это распад вещества на ионы под действием полярных молекул растворителя.
По способности распадаться на ионы электролиты делятся на сильные и слабые. Это различие носит принципиальный характер, так как для описания ряда свойств сильных и слабых электролитов применяются различные математические зависимости.
В соответствии с положением в периодической таблице элемента, образующего соответствующий электролит, к сильным электролитам относятся:
1) Основания – I-группа, II-группа начиная с Са(ОН)2 и III-группа Тl ОН;
2) Кислоты – V-группа НNО3, VI-группа Н2SО4 и Н2SеО4, VII-группа НСl, НСlО4, НСlО3 и соответствующие кислоты для брома и йода;
3) Соли – все хорошо растворимые.