Внутренняя энергия
Внутренняя энергия системы является свойством материи. Внутренняя энергия на основании кинетической теории реального газа включает в себя:
-кинетическую энергию поступательного, вращательного и колебательного
движения частиц;
-потенциальную энергию взаимодействия частиц
-энергию электронных оболочек атомов;
-внутриядерную энергию.
В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Поэтому в дальнейшем под внутренней энергией реального газа будем понимать энергию хаотического движения молекул и атомов, включающую кинетическую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного вида, а также потенциальную энергию сил парных взаимодействия между молекулами.
При Т = 0 в атомах сохраняется только движение электронов и вн. энэ. при этом называется нулевой внутренней энергией.
Внутренняя энергия системы обозначается буквой U и определяется как функция параметров состояния и поэтому называется функцией состояния (в отличие от теплоты и работы, являющихся функциями процесса – мат. – неполными дифф.).
Принципиальным признаком функцией состояния служит то, что она является полным дифференциалом и потому при осуществлении процесса определяются только начальными и конечными значениям функции, не учитывая характер процесса (изохорный, изобарный или другой), т.е.
 .
.
В отличие от внутренней энергии функции тепла или работы не является полным дифференциалом и потому при осуществлении процесса определяются не только начальными и конечными значениям функции, но и учитывается характер процесса (т.е изменение и параметров состояния).Вследствие этого, например
 .
.
Кинетическая энергии молекул является функцией температуры и зависит от средней скорости молекул. Значение потенциальной энергии, возникающей при парном взаимодействии молекул, зависит от среднего расстояния между молекулами и, следовательно, является функцией удельного объема v.
Внутренняя энергия U идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления, а определяется только его температурой.
Для сложной системы, состоящей из смеси газов, она определяется суммой энергий отдельных частей, т. е. обладает свойством аддитивности.
Величина u=U/M, называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества.
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно.
Например, в соответствии с международным соглашением для воды за нуль принимается значение внутренней энергии при температуре 0,01 °С и давление насыщенного водяного пара при этой температуре 610,8 Па, а для идеальных газов—при О °С вне зависимости от давления.
В дальнейшем для краткости будем называть величину и просто внутренней энергией.
Дифференциал внутренней энергии равен
 ,
,
где cv – истинная удельная массовая теплоёмкость при постоянном объёме, Т – температура рабочего тела.
В практических расчётах приращение внутренней энергии определяется формулой
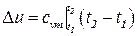
где  - средняя теплоёмкость при постоянном объёме в интервале температур t1 и t2.
- средняя теплоёмкость при постоянном объёме в интервале температур t1 и t2.