Энергия Гиббса химической реакции
Раздел химической термодинамики, изучающий тепловые эффекты химических реакций, называетсятермохимией. Уравнения химических реакций, в которых указаны их тепловые эффекты, называются термохимическими уравнениями.
Тепловые эффекты химических реакций–теплота, выделенная или поглощенная термодинамической системой при протекании в ней химической реакции. Определяется при условии, что система не совершает никакой работы (кроме возможной работы расширения), а температуры реагентов и продуктов равны.
При постоянном давлении (p) и отсутствии других видов работ кроме работы против внешнего давления из первого закона термодинамики можно получить:
ΔQ = ΔH = ΔU + pΔV.
Таким образом тепловой эффект химической реакции равен ΔН, которая в термодинамике носит название энтальпия.
Из первого закона термодинамики следует, что тепловой эффект химической реакции(при р = const и Т = const)не зависит от пути ее протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции (закон Г. И. Гесса).
Термохимические расчеты. В основе большинства термохимических расчетов лежит следствие из закона Гесса: тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции(ΔН)за вычетом суммы теплот (энтальпий) образования исходных веществ с учетом стехиометрических коэффициентов(n, m)в уравнении реакции:
 (1)
(1)
продукты исходных
реакции веществ
Энтальпия образования химических соединений (DН) – изменение энтальпии в процессе получения этого соединения из простых веществ, устойчивых при данной температуре.
Стандартной энтальпией (теплотой) образования химического соединения (ΔН°298) называется изменение энтальпии в процессе образования одного моля этого соединения, находящегося в стандартном состоянии
(Т = 298 К и давление р = 1,01∙10–5 Па), из простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых фазах и модификациях. Стандартные энтальпии образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях. Стандартная энтальпия образования соединения – мера его термодинамической устойчивости, прочности.
Если DН > 0, реакцию называют эндотермической, если же теплота выделяется в окружающую среду DН < 0, реакцию называют экзотермической.
Поскольку значение DН определяется по уравнению (1) и не зависит от пути и способа проведения процесса, энтальпию относят к термодинамическим функциям состояния системы.
Первый закон (или начало) термодинамики ничего не говорит о направлении процесса, т.е. о направлении химической реакции. На этот вопрос отвечает второе начало термодинамики. Второй закон термодинамики выполняется только для систем, состоящих из большого количества молекул, для которых применимо понятие – вероятность состояния системы.
Число микросостояний системы, которые могут обеспечить данное макросостояние системы, называют термодинамической вероятностью(W). Больцман установил связь между термодинамической вероятностью и энтропией системы (S):
S = k lnW,
где k – постоянная Больцмана, k = R / NA.
Изменение энтропии, как правило, определяется по уравнению
ΔS = ΔQ / T.
Энтропия является мерой неупорядоченности состояния системы. При переходе системы из менее упорядоченного состояния (с большим беспорядком) в более упорядоченное (с меньшим беспорядком) энтропия убывает. При переходе из газообразного в жидкое, а затем в кристаллическое (твердое) состояние степень беспорядка убывает, при этом убывает и энтропия системы. Энтропия – термодинамическая функция состояния системы (Дж/(моль×К)). Изменение энтропии (DS) при химических реакциях определяется следующим образом:
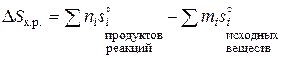 .
.
На основании понятия энтропии, второй закон термодинамики формулируется следующим образом: в изолированной системе самопроизвольно, т.е. без подвода энергии извне, совершаются только те процессы, которые обеспечивают повышение энтропии системы.
Третий закон термодинамики касается абсолютного значения энтропии. В настоящее время определить экспериментально или рассчитать абсолютное значение внутренней энергии и энтальпии не представляется возможным. Однако абсолютное значение энтропии определить возможно. Если принять, что при температуре абсолютного нуля все вещества находятся в кристаллическом состоянии, и при этом отсутствует всякое движение атомов и (или) молекул, за исключением движения электронов, то термодинамическая вероятность такого состояния будет равна единице (W = 1). Таким образом, используя уравнение Больцмана для расчета энтропии, получи, что при данной температуре S = 0. Это и есть третий закон термодинамики.
Объединив уравнения ΔQ = ΔU + pΔV + ΔA* и ΔS = ΔQ / T, и учитывая, что ΔH = ΔU + pΔV получим
Т ΔS = ΔH + ΔА* или ΔА* = – (ΔH – Т ΔS).
В термодинамике величину ΔH – Т ΔS = ΔG определяют как изменение энергии Гиббса.Энергия Гиббса (H – Т S = G) есть термодинамическая функция состояния системы, а ее изменение при химических взаимодействиях DG – энергиея Гиббса химической реакции.
Поскольку работа есть величина положительная, то система совершает работу над окружающей средой только в том случае, если энергия Гиббса будет меньше нуля (ΔG < 0). Таким образом, в закрытой системе самопроизвольно совершаются только те процессы, которые идут с уменьшением энергии Гиббса. Пределом этой убыли является минимальное значение G, отвечающее состоянию равновесия системы.
Если ΔG > 0, то процесс самопроизвольно протекать не может. В случае если ΔG = 0, т.е. ΔH = Т ΔS, то имеет место такое состояние, при котором реакция не идет ни в прямую, ни обратную сторону. Это состояние называется равновесным.
Из сказанного следует, что DG является критерием направления и предела самопроизвольного протекания изобарно-изотермического процесса. Из уравнения ΔG = ΔH – Т ΔS следует, что протекание самопроизвольной химической реакции зависит от двух факторов:
1) ΔH – стремление системы обладать минимальным запасом внутренней энергии;
2) Т ΔS – стремление системы принимать состояние с наиболее возможным беспорядком.
Энергия Гиббса образования химических соединений.Энергия Гиббса химической реакции DG, являясь изменением термодинамической функции состояния системы G, может быть вычислена по разности
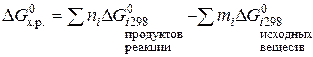 .
.
Стандартной энергией Гиббса образования химического соединения DG°обр называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. Необратимых реакций не так много. Большинство реакций являются обратимыми. Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
Таким образом, химическая термодинамика отвечает на вопросы:
− о возможности протекания реакции самопроизвольно в нужном направлении;
− сколько при этом выделится энергии;
− когда процесс закончится, т.е. наступит равновесие;
− если процесс самопроизвольно протекать не может, то сколько необходимо подвести энергии или какие необходимо создать условия (температура, давление, концентрация и другие факторы) для его протекания.
Химическая (равновесная) термодинамика не отвечает на вопрос о скорости процесса.

Лекция 5. Химическое равновесие
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Состояние равновесия наиболее устойчиво, и всякое отклонение от него требует затраты энергии. Например, в реакции синтеза аммиака равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород. Следовательно, химическое равновесие можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим равновесием. Концентрации всех реагирующих веществ (как исходных, так и образующихся) остаются строго постоянными. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными.
На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газообразных веществ и давление. При изменении одного из этих параметров равновесие нарушается и концентрация всех реагирующих веществ изменяется до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия в сторону продуктов реакции. Если же увеличивается концентрация исходных веществ, то равновесие смещается в сторону их образования.
Состояние химического равновесия характеризуется константой равновесия.
например, для гомогенной реакции
aA + bB « cC + dD
выражение для скорости прямой реакции в соответствии с законом действия масс:
vпр = kпр[A]a [B]b,
где kпр – константа скорости прямой реакции; [A] и [B] – концентрации веществ.
Аналогично, для обратной реакции:
vобр = kобр[С]с [D]d.
Так как в состоянии равновесия скорости прямой и обратной реакций равны, то
kпр[A]a [B]b = kобр[С]с [D]d,
отсюда
К = kпр / kобр = [С]с [D]d / [A]a [B]b.