Химические свойства металлов.
Лекция 18. Общие свойства металлов
Ключевые слова: Металлическая связь, электронный газ, ряд активности металлов, активные металлы, металлы средней активности, благородные металлы, тугоплавкие металлы, «амфотерные» металлы.
Из 110 известных к настоящему времени элементов только 22 относятся к неметаллам, большинство же элементов – металлы. К металлам относят все s-, d-, f-элементы, а также p-элементы, условно располагающиеся в нижней части периодической системы от диагонали, проведенной от бора к астату.
Металлы – это элементы, между атомами которых осуществляется металлическая связь. Это сильно нелокализованная связь, когда свободные электроны (электронный газ) связывают положительные ионы металла, находящиеся в узлах кристаллической решетки. Для осуществления металлической связи необходимо, чтобы атомы имели свободные орбитали на валентном уровне. Металлическая связь ненасыщенна и ненаправлена: она объединяет очень большое число атомов и при дальнейшем их увеличении делокализация электронов усиливается. Перекрывание s-орбиталей зависит только от расстояния между ними и не зависит от направлений по которым они сближаются.
Металлам присущи характерные признаки, проявляющиеся, как правило, одновременно:
1. Твердость – сопротивление к царапанью, вдавливанию
2. Пластичность – способность необратимо деформироваться под действием механических нагрузок.
3. Блеск – способность компактного куска металла отражать свет.
4. Большая электро- и теплопроводность. Все эти физические свойства можно объяснить наличием электронного газа в компактном куске металла.
5. Тугоплавкость – если Тпл>1359 0C – тугоплавкие (Ti, Zr, V, Cr, Mo, W) – это связано с прочностью кристаллических решеток этих металлов.
Главным признаком металлов, как химических веществ, является их способность терять электроны при взаимодействии с другими атомами, проявляя восстановительные свойства. В соответствии с восстановительной способностью получен ряд химической активности металлов: от Li до Al – активные, от Al до H+ – средней активности. Металлы, расположенные в ряду активности справа от водорода, называют малоактивными или благородными.
1. Металлы реагируют с простыми веществами - неметаллами: со фтором – почти все металлы, продукты реакции называют фториды; хлором – почти все, продукты реакции называют хлориды; кислородом – многие металлы, продукты реакции называют оксиды; серой – многие при нагревании, продукты называют сульфидами; водородом, азотом – щелочные и щелочно - земельныне металлы, продукты реакции гидриды и нитриды, соответственно.
2. С водой взаимодействуют, вытесняя водород из воды, только те металлы, значение электродных потенциалов которых значительно меньше чем у воды (–0,41 В).
2Li + 2H2O ® 2LiOH + H2
Металлы, расположенные между магнием и свинцом пассивируют протекание реакции, с образованием защитной оксидной пленки.
3. Металлы, стоящие в ряду электродных потенциалов левее водорода, взаимодействуют с хлороводородной кислотой. Окислителем в хлороводородной кислоте является ион водорода H+:
Fe + 2HCl ® FeCl2 + H2
4. Металлы взаимодействуют с серной кислотой. В разбавленной, также как в хлороводородной кислоте, окислителем является ион водорода:
Ме + Н2SO4 (разб.) ® MeSO4 + H2
В концентрированной серной кислоте в роли окислителя выступает атом серы 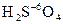 . В этом случае становится возможным окисление некоторых благородных металлов.
. В этом случае становится возможным окисление некоторых благородных металлов.
3Cu + 4H2SO4 ® 3CuSO4 + S¯ + 4H2O
4. Более сильным окислителем, чем серная кислота является азотная. В разбавленной азотной кислоте окислителем выступает атом азота 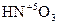 . Продуктами восстановления азота могут являться NH4NO3, N2, N2O, NO. Концентрированная азотная кислота обычно восстанавливается до NO.
. Продуктами восстановления азота могут являться NH4NO3, N2, N2O, NO. Концентрированная азотная кислота обычно восстанавливается до NO.
5. Действие растворов щелочей возможно только на «амфотерные» металлы Be, Al, Zn, Sn, Pb. Причем реакция протекает в две стадии: реакция металла с водой с образованием гидроксида и водорода, реакция гидроксида металла со щелочью.