Теплоемкость газов.
Решение.
1. Определяем удельную газовую постоянную
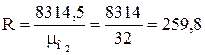 , Дж/(кг·К).
, Дж/(кг·К).
2) Определяем массу кислорода при начальных параметрах
 , кг.
, кг.
3) Определяем массу кислорода при конечных параметрах
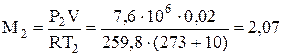 , кг.
, кг.
4) Масса израсходованного кислорода
 , кг.
, кг.
Теплоемкостью рабочего тела (газа, пара) называется количество теплоты которое необходимо сообщить телу для изменения его температуры на 1К. (т. е. c=DQ/DT).
В зависимости от того, в каких единицах задано количество вещества, используют следующие удельные теплоемкости:
«c»- удельная массовая теплоемкость, отнесенная к 1кг газа, Дж /(кг×К)
«c¢»- удельная объемная теплоемкость, (при нормальных физических условиях) отнесенная к 1м3газа, Дж/( м3×К)
«mc»- удельная мольная теплоемкость, отнесенная к 1 кмоль газа, Дж/(кмоль×К)
Удельные теплоемкости связаны между собой:
c=mc/m; c¢=c×rо; mc =c×m (1.13)
Теплоемкость идеального газа зависит от характера процесса, атомности газа и температуры.
Теплоемкость в процессе при постоянном давлении называется изобарной и обозначается cр; cр¢; mcр;
Теплоемкость при постоянном объеме, называется изохорной cv; cv¢; mcv .
Связь между теплоемкостями устанавливается уравнением Майера:
- для массовой теплоемкости cр- cv=R
- для молярной теплоемкости
mcр-mcv=Rm=8314,5 Дж/(кмоль×К). (1.14)
Отношение изобарной теплоемкости к изохорной, называется показателем адиабаты
 (1.15)
(1.15)
А также с учетом газовой постоянной
 ;
; 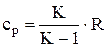
Аналогично для молярной теплоемкости
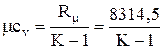 ;
; 
Учитывая, что теплоемкости двухатомных и многоатомных газов с ростом температуры увеличиваются, поэтому в расчетах определяют среднюю теплоемкость для заданного интервала температур T1…..Т2 по следующим формулам
 , (1.16)
, (1.16)
 , (1.17)
, (1.17)
где
 и
и  ;
; 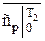 и
и 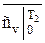 - берутся из таблицы соответствующих газов [ ].
- берутся из таблицы соответствующих газов [ ].
По известным значениям средней теплоемкости можно определить удельную теплоту q или общее количество теплоты Q ,подведенное к рабочему телу
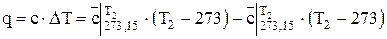 , Дж/кг (1.18)
, Дж/кг (1.18)


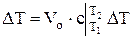 , Дж, (1.19)
, Дж, (1.19)
где N-число молей, Vо =М/rо =V×r/ rо - объем газа приведенный к нормальным условиям.
В соответствии с условиями подвода теплоты следует пользоваться либо изобарными – либо изохорными теплоемкостями.
А также средними значениями теплоемкостей для интервала температур DТ, в неточных расчетах теплоемкость принимается постоянной (const) Определение теплоемкостей для различных газов можно также выполнять по формулам приведенным в приложении П2.
Пример 1.4Воздух в количестве 6 м3 находится под избыточным давлением Р1= 3 бара и t1= 25 оС нагревается при Р=const до t2= 130 оС.
Определить количество теплоты подведенной к воздуху, если с = const, Rв=287 Дж/кг·К, мольная теплоемкость при Р = const μСр= 29,33 кДж/кмоль·К. Молекулярная масса воздуха М=28,96 кг/кмоль.