Измерение скорости химической реакции
Зарождение цепи начинается с элементарного химического акта, в результате которого образуется активная частица. Этот процесс требует затраты энергии и может идти при нагревании вещества, воздействии ионизирующего излучения, действии катализатора.
Одна из этих реакций может протекать самостоятельно, а вторая реакция осуществима только в присутствии первой. Таким образом, протекание одной реакции инициирует осуществление второй.
Сопряжённые реакции возможны в биохимии. Они протекают в клетках, причём энергию, необходимую для течения второй реакции с ΔG2 > 0, доставляет первая реакция, для которой ΔG1 < 0. Причём │ΔG1│> │ΔG2│, т.е. весь процесс в целом протекает с уменьшением энергии Гиббса. Подобные биохимические реакции иначе называются тандемными.
Часто механизм сопряжённых реакций заключается в образовании на первой стадии активных промежуточных частиц (радикалов или ионов), которые инициируют протекание всех остальных реакций.
Схему сопряженных реакций такого типа можно в общем виде представить следующим образом:

где С – активная промежуточная частица.
Например, бензол в водном растворе не окисляется Н2О2, но при добавлении соли двухвалентного железа происходит его превращение в фенол и дифенил. Чтобы «запустить данный процесс, ионы Fe2+ сперва вступают во взаимодействие с Н2О2, образуя радикалы ·ОН
Fe2+ + H2O2 → Fe3+ + OH– + ˙OH,
которые затем реагируют как с бензолом
С6Н6 + ˙ОН → ˙С6Н5 + Н2О
˙С6Н5 + ˙ОН → С6Н5ОН
так и с Fe2+
Fe2+ + ˙OH → Fe3+ + OH–
Явление химической индукции впервые было исследовано Н.А. Шиловым в 1905 г.
Цепными называют химические реакции, протекающие через ряд регулярно повторяющихся элементарных стадий с участием активных частиц, содержащих в своём составе атомы с неспаренными электронами на внешнем энергетическом уровне (или по другому – свободных радикалов).
К цепным относятся реакции горения, полимеризации и поликонденсации, распада ядер и др.
Механизм цепных реакций состоит в том, что свободные радикалы (часто в их роли выступают одиночные атомы) обладают высокой химической активностью. Они легко вступают во взаимодействие с устойчивыми молекулами и превращают их в активные частицы, которые затем образуют продукты реакции и новые радикалы, и таким образом возникает цепь дальнейших стадий. Цепная реакция продолжается, пока не прореагирует всё вещество, или пока не исчезнут активные частицы-радикалы.
Для цепных реакций характерны три этапа: 1) зарождение цепи; 2) развитие цепи или её рост; 3) обрыв цепи.
Например, в реакции синтеза хлороводорода и водорода и хлора, протекающей по цепному механизму (Н2 + Cl2 = 2 HCl), возникновению цепи соответствует процесс
Cl2  2 ∙Сl
2 ∙Сl
Развитие цепи представляет собой периодическое повторение стадий реакции с участием образовавшихся радикалов. Они иначе называются звеньями цепи:
Н2 + ·Cl → HCl + ˙H
˙H + Cl2 → HCl + ˙Cl
H2 + ˙Cl → HCl + ˙H
Cl2 + ˙H → HCl + ˙Cl и т.д.
Длина цепи определяется числом молекул исходного вещества, прореагировавшего в результате одного акта зарождения цепи, до её обрыва.
По особенностям стадии развития цепные реакции делят на неразветвлённые и разветвлённые. В первом случае количество свободных активных частиц-радикалов остаётся неизменным на протяжении всего данного этапа.
В разветвлённых цепных реакциях расход одной активной частицы приводит к образованию нескольких (двух или более) других активных частиц. Схематически это можно представить следующим образом:
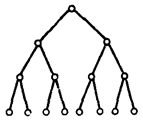
Обрыв цепи соответствует исчезновению активных частиц в результате их взаимодействия друг с другом:
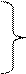 ˙H + ˙H = H2
˙H + ˙H = H2
˙Cl + ˙Cl = Cl2 обрыв цепи
˙H + ˙Cl = HCl
Кроме того, он может происходить при адсорбции частиц стенками сосуда, при столкновении двух активных частиц с третьей (называемой ингибитором), которой активные частицы отдают избыточную энергию. Поэтому для цепных реакций характерны зависимость их скорости от размеров, формы и материала реакционного сосуда, от наличия посторонних инертных веществ, выполняющих роль ингибитора.
Скорость неразветвлённых цепных реакций определяется скоростью наиболее медленной стадии, т.е. зарождением цепи. Для каждой стадии в реакциях данного типа используются обычные уравнения химической кинетики (первого или второго порядка).
Разветвлённые химические реакции могут протекать по сложному кинетическому закону и не иметь определённого порядка. «Размножение» радикалов в них часто приводит к лавинообразному течению процесса, которое вызывает взрыв. Однако и в этих реакциях возможен обрыв цепи. Поэтому бурное увеличение скорости процесса (вплоть до взрыва) происходит в том случае, если темп разветвления цепи опрежает темп её обрыва. Теория цепных реакций была разработана в трудах академика Н.Н. Семёнова, С.Н. Хиншельвуда (Англия) и др. учёных.
Существуют цепные реакции, в которых в роли активных частиц выступают не радикалы, а ионы, образующиеся в результате гетеролитического разрыва химической связи:
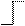 А : В → Аˉ: + В+
А : В → Аˉ: + В+
Подобный механизм на практике часто реализуется в реакциях полимеризации непредельных органических соединений.
Для экспериментального определения скорости химической реакции необходимо иметь данные об изменении концентрации исходных или конечных веществ во времени. Методы, с помощью которых это можно сделать, подразделяются на химические и физико-химические.