Диссоциация воды. Водородный показатель
Чистая вода плохо проводит электрический ток, но всё же обладает измеримой электропроводностью, которая объясняется частичной диссоциацией молекул Н2О на ионы водорода и гидроксид-ионы:
Н2О 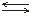 Н+ + ОН–
Н+ + ОН–
По величине электропроводности чистой воды можно вычислить концентрацию в ней ионов Н+ и ОН–. При 25оС она равна 10–7 моль/л.
Константа диссоциации Н2О рассчитывается следующим образом:
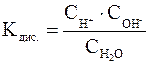
Перепишем это уравнение:
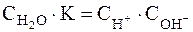
Следует подчеркнуть, что данная формула содержит равновесные концентрации молекул Н2О, ионов Н+ и ОН–, которые установились на момент наступления равновесия в реакции диссоциации Н2О.
Но, поскольку степень диссоциации Н2О очень мала, можно считать, что концентрация недиссоциированных молекул Н2О в момент наступления равновесия практически равна общей начальной концентрации воды, т.е. 55,56 моль/дм3 (1 дм3 Н2О содержит 1000 г Н2О или 1000 : 18 ≈ 55,56 (молей). В разбавленных водных растворах можно считать, что концентрация Н2О будет такой же. Поэтому, заменив в уравнении (42) произведение двух постоянных величин 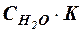 новой константой
новой константой 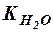 (или KW), будем иметь:
(или KW), будем иметь:
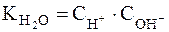
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение молярных концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Она называется иначе ионным произведением воды.
В чистой воде при 25оС 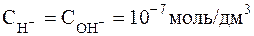 .
.
Поэтому для указанной температуры:

При увеличении температуры значении  возрастает. При 100оС оно достигает 5,5 ∙ 10–13 (рис. 34).
возрастает. При 100оС оно достигает 5,5 ∙ 10–13 (рис. 34).

Рис. 34. Зависимость константы диссоциации воды Kw
от температуры t(°С)
Растворы, в которых концентрации ионов Н+ и ОН– одинаковы, называются нейтральными растворами. В кислых растворах больше содержится ионов водорода, а в щелочных – гидроксид-ионов. Но какова бы ни была реакция среды в растворе, произведение молярных концентраций ионов Н+ и ОН– останется постоянным.
Если, например, к чистой Н2О добавить некоторое количество кислоты и концентрация ионов Н+ при этом увеличится до 10-4 моль/дм3, то концентрация ионов ОН–, соответственно, понизится так, что произведение  останется равным 10-14. Следовательно, в этом растворе концентрация гидроксид-ионов будет равна 10-14 : 10-4 = 10-10 моль/дм3. Этот пример показывает, что если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому реакцию раствора можно количественно охарактеризовать концентрацией ионов Н+:
останется равным 10-14. Следовательно, в этом растворе концентрация гидроксид-ионов будет равна 10-14 : 10-4 = 10-10 моль/дм3. Этот пример показывает, что если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому реакцию раствора можно количественно охарактеризовать концентрацией ионов Н+:
нейтральный раствор ® 
кислый раствор ® 
щелочной раствор ® 
На практике для количественной характеристики кислотности или щёлочности раствора используют не молярную концентрацию в нём ионов Н+, а её отрицательный десятичный логарифм. Эта величина называется водородным показателем и обозначается через рН:
рН = –lg [H+]
Например, если  , то рН = 2; если
, то рН = 2; если  , то рН = 10. В нейтральном растворе рН = 7. В кислых растворах рН < 7 (и тем меньше, чем «кислее» раствор, т.е., чем больше в нём концентрация ионов Н+). В щёлочных растворах рН > 7 (и тем больше, чем «щелочнее» раствор, т.е., чем меньше в нём концентрация ионов Н+).
, то рН = 10. В нейтральном растворе рН = 7. В кислых растворах рН < 7 (и тем меньше, чем «кислее» раствор, т.е., чем больше в нём концентрация ионов Н+). В щёлочных растворах рН > 7 (и тем больше, чем «щелочнее» раствор, т.е., чем меньше в нём концентрация ионов Н+).
Для измерения рН раствора существуют различные методы. Очень удобно приблизительно оценивать реакцию раствора с помощью специальных реактивов, называемых кислотно-основными индикаторами. Окраска этих веществ в растворе меняется в зависимости от концентрации в нём ионов Н+. Характеристика некоторых наиболее распространённых индикаторов представлена в таблице 12.
Таблица 12. Важнейшие кислотно-основные индикаторы
| Название индикатора | Цвет индикатора в различных средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метиловый красный | красный рН < 4,2 | оранжевый 4,2 < рН < 6,3 | жёлтый рН > 6,3 |
| Фенолфталеин | бесцветный рН < 7 | бесцветный 7 < pH < 8 | малиновый рН > 8 |
| Лакмус | красный рН < 5 | фиолетовый 5< pH < 8 | синий рН > 8 |
Из таблицы 12 следует, что с помощью индикаторов мы можем определить не точное значение рН раствора, а тот интервал, внутри которого это значение может находиться.
Существует также универсальный индикатор, с помощью которого можно определить приблизительное значение (с точностью до единицы) рН раствора в широком интервале от 0 до 14.
Для многих химических и биологических процессов величина рН раствора имеет большое значение. Так, рН крови человека имеет строго постоянное значение 7,36±0,04. Отклонение от него в ту или иную сторону даже на незначительную величину приводит к развитию в организме различных патологических (болезненных) процессов, которые могут завершиться летальным исходом. Растения нормально произрастают, если значение рН почвенного раствора лежит в определённом интервале, характерном для данного вида растения. От величины рН зависят и свойства природных вод, в частности, их коррозионная активность.
Теория кислот и оснований.
Буферные растворы