Донорно-акцепторная связь
Возможен и другой механизм образования ковалентной связи – донорно-акцепторный. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония (NH4+). В молекуле аммиака атом азота имеет неподеленную пару электронов (двухэлектронное облако)
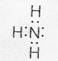
У иона водорода свободна (не запонена) 1s-орбиталь, что можно обозначить как Н+ (здесь квадрат означает ячейку). При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, то есть оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой
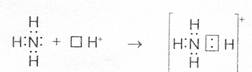
Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащая азоту, становится общей с Н+. В схемах изображение ячейки часто опускается.
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (то есть предоставляющий свободную орбиталь), называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным. Образованная таким путем ковалентная связь называется донорно-акцепторной или координационной связью.
Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертная связь N-H в ионе аммония ничем не отличается от остальных трех.
Большей частью донорами являются молекулы, содержащие атомы N, O, F, Cl связанные в ней с атомами других элементов. Акцептором может быть частица, обладающая вакантными электронными уровнями, например, атомы d-элементов, обладающие незаполненными d-подуровнями.