Производство метанола в странах СНГ и на Украине.
Острый дефицит в странах СНГ, связанный в первую очередь с перестройкой региональных экономических связей, совпал с существующими изменениями в структуре производства моторных топлив в большинстве индустриально развитых стран мира. Основной причиной таких изменений является ужесточение требований к экологическим характеристикам производимого моторного топлива. Отказ от использования тетраэтиленсвинца в качестве антидетонационной добавки и введение жестких ограничений в топливе делают необходимым поиск новых путей получения высокооктановых экологически чистых моторных топлив. Этим требованиям отвечает использование в качестве топлива метанола.
Переход на метанол в автомобильной промышленности приведет к сокращению выбросов вредных веществ в атмосферу в значительно большей степени, чем применение самых совершенных устройств по очистке выхлопов на автомобилях с бензиновыми двигателями. Давление паров метанола в 2 раза ниже давления паров бензина, поэтому испарение метанола практически не является источником загрязнения окружающей среды. Но расширение использования метанола требует значительного снижения его себестоимости. В этом заключается одна из причин поиска новых технологий получения СН3ОН. Наиболее перспективны два пути:
1) совершенствование технологии каталитического синтеза энергетических спиртов через стадию получения синтез-газа;
2) разработка технологии получения энергетических спиртов прямым гомогенным окислением природного газа.
В настоящее время предпринимаются значительные усилия для улучшения технологии каталитического синтеза спиртов в основном за счет модификации катализаторов и снижения издержек на стадии получения синтез-газа, так как около 75% себестоимости метанола связано с энергоемким процессом парового риформинга метана в синтез-газ.
Специалистами Санкт-Петербургского технологического института исследован многокомпонентный катализатор синтеза метанола. Катализатор внедрен на Новомосковском ПО “Азот” под давлением 32 МПа.Предложены модель синтеза метанола и методика расчета промышленных колонн синтеза метанола [21].
В Украине на протяжении последних лет не проводилось обновление основных фондов (износ основных фондов - 60¸80%), большинство из существующих химических производств основывается на устаревших технологиях, имеет место очень высокий уровень ручного труда. Это обуславливает высокое энерго- и материалопотребление, неэффективное использование сырья, создает проблемы с утилизацией многотоннажных отходов. В результате этого производимая продукция является неконкурентоспособной на мировом рынке, особенно это проявляется при резком увеличении цен на энергоносители. Поэтому при переходе на мировой уровень цен на нефть, газ, уголь, электроэнергию многие производства и даже предприятия нерентабельные (производство серы, аммиака, метанола и др.).
Нижев таблице приведены данные о потребности в топливно-энергетических ресурсах химической промышленности, в том числе, на производство.
| Наименование энергоресурса | 1993г. | 1995г. | 2000г. | 2005г. |
| Метанол (природный газ, млн. м3) | 1038,558 | 717,421 | 543,262 | 604,143 |
| Метанол (теплоэнергия, Гкал) | 2382,476 | 1645,780 | 1559,160 | 1472,540 |
| Метанол (электроэнергия, млн. квт) | 1517,823 | 858,228 | 855,205 | 842,377 |
Одной из главных задач модернизации многотоннажных производств является снижение энергопотребления потому, что эта группа продуктов является наиболее энергоемкой во всем химическом комплексе и определяет его общее энергопотребление в Украине. Поэтому предполагается проведение комплекса работ по модернизации агрегатов производства метанола, аммиака, карбамида, аммиачной селитры, кальцинированной соды, серной и азотной кислот.
Извышеизложенного следует, что основными потребителями метанола являются производства формальдегида, синтетического каучука, газонефтеперерабатывающая промышленность. На долю этих отраслей приходится около 60% общего расхода метанола. Начиная с 1980 года, основным потребителем метанола стало производство уксусной кислоты, базирующееся на процессе карбонилирования метанола. Такая установка закуплена по импорту и смонтирована в Северодонецком ПО “Азот”.
Таблица 1.5 Динамика потребности в метаноле и его структура в СНГ на период до 2005 г.
| Наименование направлений потребителей | Потребность в метаноле, тыс. т. 1990г. 1995г. 2000г. 2005г. | |||
| Традиционные потребители | ||||
| Всего | 3186,2 | 4111,5 | ||
| в том числе производство пластмасс | ||||
| Всего | 1238,1 | 1491,4 | 2356,1 | 2936,1 |
| в том числе формалин | 1188,5 | 1420,8 | 2256,1 | 2746,0 |
| Хлорная промышленность | ||||
| Всего | 167,8 | 388,3 | 492,7 | 618,2 |
| в том числе уксусная кислота | 104,9 | 170,1 | 232,5 | 340,2 |
| Газодобывающая промышленность | 298,0 | 322,0 | 400,0 | 400,7 |
| Синтетический каучук | 537,0 | 473,0 | 306,0 | 306,0 |
| Спецпродукты | 81,1 | 130,0 | 182,1 | 135,1 |
| Азотная промышленность | 61,7 | 67,5 | 79,4 | 79,5 |
| Диметилтерефталат | 69,1 | 71,7 | 71,7 | 71,7 |
| Себациновая кислота | 4,1 | 5,5 | 12,3 | 13,8 |
| Анилинокрасочная промышленность | 23,0 | 25,5 | 25,9 | 26,0 |
| Химические средства защиты растений | 41,3 | 42,7 | 44,0 | 44,1 |
| Высшие жирные спирты | 9,3 | 11,6 | 13,1 | 15,8 |
| Присадки и смазочные материалы | 5,1 | 9,3 | 9,5 | 19,5 |
| Производство реактивов | 1,9 | 2,2 | 2,2 | 2,2 |
| Химико-фотографическая промышленность | 3,9 | 5,1 | 5,1 | 5,6 |
| Медицинская промышленность | 25,4 | 37,9 | 49,0 | 49,5 |
| Продукты нефтеоргсинтеза | 22,5 | 27,9 | 28,1 | 28,1 |
| Лакокрасочная промышленность | 9,3 | 11,6 | 13,1 | 15,8 |
| Нефтяная промышленность | 28,0 | 28,0 | 29,4 | 29,5 |
| Прочие потребители | 19,4 | 35,0 | 41,8 | 41,8 |
| Спецпотребители | 1080,0 | 1400,0 | 1000,0 | 1000,0 |
| Новые потребители | ||||
| в том числе | ||||
| МТБЭ (метилтретбутиловый эфир) | 30,0 | 302,0 | 544,0 | 674,0 |
| Микробиологическая промышленность | 27,0 | 255,0 | 620,1 | 750,1 |
| Итого | 3783,0 | 5143,2 | 6275,6 | 7263,1 |
Данные табл.1.5 свидетельствуют о том, что потребность в метаноле за период 1990¸2005 гг. увеличится на 3480,1 тыс. т или в 1,9 раза.
К 2005 году основными потребителями метанола в странах СНГ согласно прогнозу останутся (%):
- производство формалина - 37,0
- синтетического каучука - 4,6
- уксусной кислоты - 4,6
- газонефтедобывающая промышленность - 5,5
- производство белково-витаминных концентратов - 10,0
- МТБЭ- 9,2
Впромышленно развитых странах удельный вес основных областей применения метанола несколько иной (%):
- формальдегид - 36,0
- МТБЭ- 16,2
- растворители - 8,6
- уксусная кислота - 7,6
Учитывая положительный баланс производства и потребления метанола в России и Украине, значительные его объемы поставляются на экспорт.
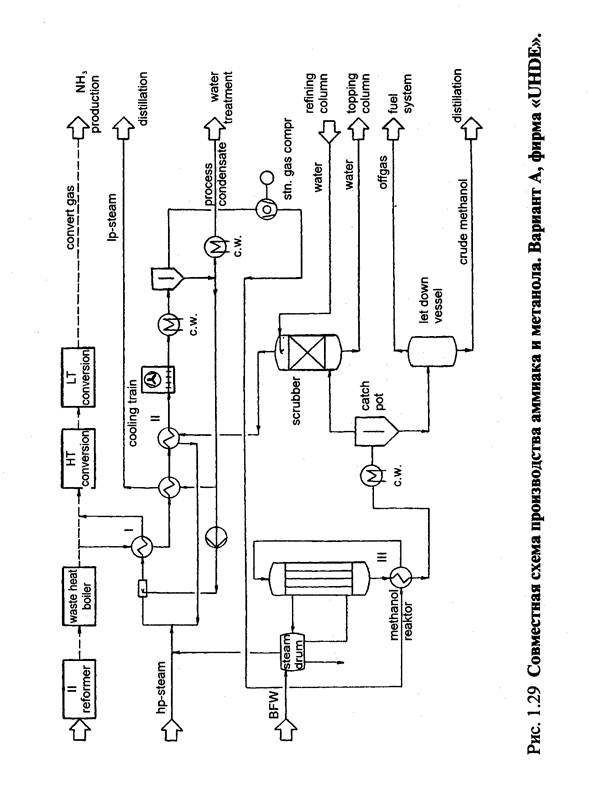
Германская фирма “UHDE GmbH” разработала три технологические схемы совместного производства аммиака и метанола.
Базовая производительность по аммиаку трех проектов составляет 1200 т/сутки. При работе по схеме с производством метанола производительность по аммиаку составляет 1100 т /сутки и 200 т/сутки по метанолу (рис.1.28-1.30).
Немецкие специалисты разработали метод совместного производства метанола и аммиака из легких углеводородов, в частности СН4, под высоким давлением. Смесь СН4 и водяного пара подогревают и направляют в трубчатый реактор получения синтез-газа в соотношении Н2:СО > 3:1. После очистки от СО2 смесь СО и Н2 поступает в реактор синтеза метанола с циркуляцией газовой смеси. Синтез метанола проводят под давлением 5¸15 МПа в присутствии соответствующего катализатора.
После отделения метанола выходящий газ содержит Н2 и малое количество СН4, N2 и метанола. После системы очистки получают чистый Н2, часть которого подают на сжигание в смеси с воздухом Н2 + 0,5О2=Н2О и получением азота. Далее смесь азота и водорода поступает в реактор синтеза метанола. Данный способ позволяет получать NH3 с малыми энергетическими затратами. Суточная производительность установки 2500 т метанола и 950т NH3 в сутки.
В Англии разработан совмещенный процесс производства метанола и аммиака [7], первой стадией которого является получение метанола. Для получения аммиака из непрореагировавших газов синтеза метанола извлекают водород 99,999% чистоты фильтрацией через мембраны, смешивают его с азотом, полученным из воздуха. Образованную таким образом АВС, направляют на синтез аммиака, который проводят под давлением, равным давлению водорода. По данному процессу может быть произведено 2547 т /сутки метанола и 771 т/сутки аммиака. Использование этого процесса позволяет снизить расход энергии в традиционной схеме производства аммиака до 6,3¸б,7 Гкал/т NH3.
Английскими специалистами предлагается также совмещенный процесс получения метанола и аммиака, который заключается в том, что газообразное углеводородное сырье подвергается первоначальному риформингу паром для получения газа для синтеза метанола, содержащего Н2 и СО. Продувочный газ после синтеза метанола подвергается вторичному паровому риформингу воздухом для получения синтез-газа производства аммиака, содержащего H2, N2, CO2, CO.Этот газ подвергается высокотемпературной конверсии СО с целью уменьшения его содержания, а после снижения СО синтез-газ проходит ряд ступеней для удаления СО и СО2и далее на получение аммиака.
В СШАразработан способ совместного получения аммиака и метанола, исключающий образование метиламинов. Способ предусматривает:
1. Очистку углеводородного (до СН4)сырья, например природного газа, от сернистых соединений при температуре 400°С в присутствии Со-Мо катализатора и оксидцинкового поглотителя.
2. Паровую конверсию очищенного от сернистых соединений углеводородного сырья при соотношении пар : газ 2¸4 моля на 1 моль сырья на никелевом катализаторе до Н2 и СО при температуре 800¸900°С и давлении 1,5¸4,0 МПа.
3. Синтез метанола при температуре 240¸270°С, давлении 4¸10 МПа в присутствии цинкмедных (Cu - Zn) или цинкхроммедных (Cu - Zn - Cr) катализаторов.
4. Отделение метанола от газовой смеси состава, % моль.:
H2 - 70¸80
CH4 - 10¸20
CO - 1¸2
CO2 - 1¸2
N2 - 0¸5
CH3OH - 0¸1.
Газовая смесь подается на паровую конверсию и используется для синтеза аммиака.
При этом метанол и метан разлагают до Н2, CO и СО2при взаимодействии с водяным паром на Ni-катализаторе при температуре 830¸900°С и давлении 4¸5 МПас последующим частичным сжиганием H2, CO и CH4при добавлении воздуха. Газовую смесь с температурой 1000¸1050°С и давлением 3,9¸4,9 МПаохлаждают до температуры 350¸370°С и превращают CO c H2O в СО2 и Н2на Fe-Cr-катализаторе до остаточного содержания СО2,0¸2,5% моль.; поглощают СО2, пропуская смесь через амин или водный раствор К2СО3(до остаточного содержания СО2 1,0¸2,0% моль.).


СО и СО2, присутствующие в газовой смеси, используются для дополнительного синтеза метанола при температуре 210¸270°С, давлении 10¸30 МПа;остаточное содержание СО и СО2составляет, соответственно, менее 0,3 и 0,5% моль. Отходящие газы нагревают до 300°С в присутствии Ni-катализатора гидрирования СО и СО2 в СН4 и направляют на синтез аммиака, который ведут на железном катализаторе при температуре 380¸500°C, давлении 10¸30 МПа.
Отечественными исследователями усовершенствован способ совместного производства аммиака и метанола.
Способ включает:
- очистку природного газа от соединений серы гидрированием;
- пароуглекислотную конверсию очищенного природного газа;
- очистку конвертированного газа от диоксида углерода;
- синтез метанола и аммиака с выделением продувочных газов и возврат их на стадию очистки от соединений серы.
Отличие заключается в том, что с целью снижения расхода природного газа и исключения выброса в атмосферу вредных примесей 65¸80% об. потока очищенного конвертированного газа направляют на синтез метанола, а продувочные газы синтеза метанола смешивают с остальной частью конвертированного газа и подвергают паровоздушной конверсии, после чего из конвертированного газа выделяют оксид углерода и направляют его на синтез метанола; затем конвертированный газ подвергают очистке от углекислоты, которую направляют на пароуглекислотную конверсию и после конверсии оставшийся газ подают на синтез аммиака.
Внедрение данного способа в промышленность позволит обеспечить экономию природного газа и исключить вредные выбросы в атмосферу путем максимального использования компонентов конвертированного газа.