Клеточные системы антирадикальной защиты
В нормальных условиях процесс перекисного окисления липидов находится под строгим контролем ферментативных и неферментативных систем клетки, от чего скорость его невелика. Принято делить химические соединения и физические воздействия, влияющие на скорость перекисного окисления липидов, на прооксиданты (усиливают процессы перекисного окисления) и антиоксиданты (тормозят перекисное окисление липидов). К прооксидантам в живой клетке относятся высокие концентрации кислорода (например, при длительной гипербарической оксигенации больного), ферментные системы, генерирующие супероксидные радикалы (например, ксантиноксидаза, ферменты плазматической мембраны фагоцитов и др.), ионы двухвалентного железа. Хотя сам процесс перекисного окисления развивается в виде цепных реакций в липидной фазе мембран и липопротеинов, начальные (а возможно, и промежуточные) стадии этой сложной системы реакций протекают в водной фазе. Часть защитных систем клетки также локализуется в липидной фазе, а часть - в водной фазе. В зависимости от этого можно говорить о водорастворимых и гидрофобных антиоксидантах. В таблице 3 приведены наиболее известные антиоксиданты.
Таблица 3. Наиболееизвестные антиоксиданты
| Антиоксидант | Действие |
| Церулоплазмин (плазма крови) | Окисляет Fe2+ до Fe3+ молекулярным кислородом |
| Апо-белок трансферрина (плазма крови) | Связывает Fe3+ |
| Ферритин (цитоплазма) | Окисляет Fe2+ и депонирует Fe3+ |
| Карнозин | Связывает Fe2+ |
| Супероксиддисмутазы (повсеместно) | Удаляет супероксид с образованием пероксида водорода |
| Каталаза (внутри клеток) | Разлагает пероксид водорода с выделением кислорода |
| Глутатион-пероксидазы (в цитоплазме) | Удаляет пероксид водорода за счет окисления глутатиона Удаляет гидроперекиси липидов |
| Глутатионредуктаза | Восстанавливает окисленный глутатион |
| Токоферол, тироксин, стероиды | Перехватывают радикалы липидов |
| Аскорбиновая кислота | Регенерирует окисляющиеся токоферол и убихинон |
| Глутатион | Используется для восстановления пероксидов |
Антиоксиданты водной фазы
Основные реакции в водной фазе, предшествующие цепному окислению, и роль антиоксидантов в ограничении скорости этих процессов можно представить в виде схемы, приведенной на рис. 5. Непосредственными предшественниками гидроксильного радикала, инициирующего цепное окисление липидов, служат ионы двухвалентного железа и перекись водорода (или образующийся из нее гипохлорит). По этой причине образование радикала гидроксила и пероксидация липидов тормозится веществами, снижающими концентрацию одного из этих двух соединений. К ним относятся:
Фермент супероксиддисмутаза, который снижает концентрацию супероксидных радикалов и тем самым препятствует восстановлению ими ионов трехвалентного железа до двухвалентного. В клетке ионы железа хранятся в трехвалентном состоянии в специальных депо, образованных субъединицами белка ферритина.
Ферменты каталаза и глутатион-пероксидаза, которые удаляют перекись водорода. Эффективность работы глутатион-пероксидазы зависит от концентрации свободного глутатиона, при снижении которой может возрастать концентрация цитотоксических гидроксильных радикалов.
Регенерация восстановленного глутатиона (GSH) из окисленного (GSSG) осуществляется за счёт НАДФН; этот процесс катализируется ферментом глутатионредуктазой. Недостаток глутатиона в клетках, например эритроцитах, который может быть обусловлен действием токсических веществ, например ионами тяжелых металлов или наследственным недостатком глутатионредуктазы приводит к активации перекисного окисления; это, в частности, наблюдается при некоторых видах гемолитических анемий.
Соединения, связывающие ионы железа (комплексоны). Надо, правда, оговориться, что в водной фазе некоторые комплексы ионов железа вступают в реакции с супероксидным радикалом и перекисью водорода наряду со свободными ионами железа в растворе.
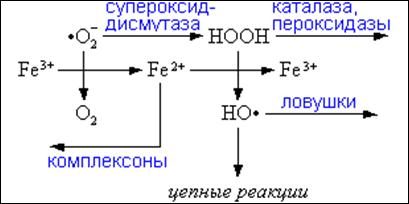 рис.5.
рис.5.
Роль антиоксидантов водной фазы.