Способы выражения концентрации растворов
Важнейшей характеристикой всякого раствора является концентрация. Концентрацией называется содержание растворенного вещества в единице массы или объема раствора или растворителя. В химии используется несколько различных способов выражения концентрации. Кратко рассмотрим наиболее часто употребляемые.
1. Массовая доля (процентная концентрация) (ω) - отношение массы растворенного вещества к общей массе раствора(выражается в процентах или в долях единицы):
 , (6.1)
, (6.1)
mр-ра = V r , (6.2)
где V – объем раствора (мл); r - плотность раствора (г/мл).
Например: имеется раствор какого-либо вещества с массовой долей 5 %. Это значит, что 5 % от общей массы раствора приходится на растворенное вещество, и 95 % - на растворитель. Массовая доля вещества составляет 0,05.
Пример 1. В 450 г воды растворили 50 г вещества. Найти массовую долю вещества в растворе.
Решение.Общая масса раствора составляет 500 г (450+50).
По формуле (6.1): 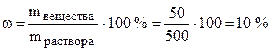 .
.
Пример 2. Сколько г Na2SO3 потребуется для приготовления 5 л 8%-го раствора (r = 1,075 г/мл)?
Решение. Находим массу раствора: m = V·r = 5000 мл·1,075 г/мл = 5375 г.
Отсюда:
5375 г раствора - 100 %
x г вещества - 8 % x = (8·5375)/100 = 430 г Na2SO3.
Пример 3.Сколько литров газообразного хлороводорода (н.у.) нужно растворить в 250 г воды для получения 20% -й соляной кислоты?
Решение.20 %-й раствор - это 20 г хлороводорода и 80 г воды. Составляем пропорцию:
20 г HCl - 80 г H2O
X г - 250 г. Отсюда X = 62,5 г HCl.
Найдем объем HCl (н.у.), учитывая, что 1 моль HCl (т.е. 36,5 г) при этих условиях занимает объем 22,4 литра:
36,5 г HCl - 22,4 л
62,5 г - X л X = 38,4 л.
Пример 4.В каком объёме воды следует растворить 10,0 г Na2CO3·10H2O для получения раствора, содержащего 10 % безводной соли?
Решение.М (Na2CO3·10H2O) = 286 г/моль. М (Na2CO3) = 106 г/моль.
Найдем, сколько граммов безводной соли содержится в 10,0 г кристаллогидрата:
в 286 г Na2CO3·10H2O содержится 106 г Na2CO3
10,0 г - X г X = 3,706 Na2CO3 г.
Согласно условию задачи масса безводной соли составляет 10 % массы всего раствора, т.е. раствора должно быть 37,06 г. Тогда масса воды равна
37,06 (раствора) – 10,0 г (кристаллогидрата) = 27,06 г. Т.к. r воды = 1,0 г/мл, то её нужно 27,06 мл .
Пример 5.В 450 г воды растворили 50 г CuSO4·5H2O. Вычислить процентное содержание кристаллогидрата и безводной соли.
Решение.Общая масса раствора составляет (450 + 50) = 500 г. Процентное содержание кристаллогидрата находим из пропорции:
500 г раствора - 100 %
50 г растворенного вещества - Х Отсюда Х = 10 %.
Найдем, сколько безводной соли содержится в 50 г кристаллогидрата:
в 1 моль CuSO4·5H2O, т.е. в 250 г содержится 1 моль, т.е. 160 г CuSO4
50 г - Х г
Отсюда Х = 32 г, что составит 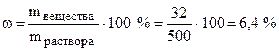 от
от
общей массы раствора.
Пример 6.Сколько моль кристаллогидрата Na2HPO4·2H2O следует растворить в 1кг воды, чтобы получить 4 %-й раствор по чистой соли?
Решение. Найдем, сколько граммов чистой соли надо растворить в 1 кг воды для получения 4%-го раствора:
4 г Na2HPO4 - 96 г воды
Х г - 1000 г . Отсюда Х = 41,7 г Na2HPO4.
Рассчитаем массу кристаллогидрата, в которой содержится 41,7 г безводной соли:
в 1 моль Na2HPO4.2H2O, т.е. в 178 г, содержится 1 моль, т.е. 142 г Na2HPO4
Х г - 41,7 г
Х = 52 г, что составляет  0,3 моль Na2HPO4·2H2O.
0,3 моль Na2HPO4·2H2O.
2. Мольная доля (χ) - отношение количества вещества одного растворенного компонента раствора к общему количеству всех компонентов.
 ;
; 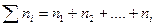 . (6.3)
. (6.3)
Она также может быть выражена в процентах.
χi - безразмерные величины, для которых  χi = χ1 + χ2 + ….χi = 1.
χi = χ1 + χ2 + ….χi = 1.
Мольную долю растворенного вещества в растворе с известной массовой долей легко определить:
χ1 =  :
: , где (100 - ω1) - массовая доля воды.
, где (100 - ω1) - массовая доля воды.
 Например, для 8%-го раствора Na2SO4 (М = 142 г/моль):
Например, для 8%-го раствора Na2SO4 (М = 142 г/моль):
χ1 = 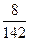 :
: 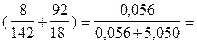 0,011 = 1,1 %.
0,011 = 1,1 %.
3. Молярная концентрация или молярность (СМ) - число молей растворенного вещества в 1 литре раствора (моль/л). Единицу измерения этой концентрации заменяют для кратности буквой М.
Пример 7. Сколько граммов KOH содержится в 500 мл 5 М раствора?
Решение. 5 М раствор - это 5 моль KOH в 1 л раствора. М KOH = 56 г/моль. Составляем пропорцию:
1л раствора - 5×56 г вещества
0,5л - x г x = 0,5×5×56 = 140 г KOH.
4. Молярная концентрация эквивалентов или эквивалентная концентрация (СЭК) - количество (моль) эквивалентов растворенного вещества в 1 л раствора (моль экв/л). Единицу измерения этой концентрации заменяют для кратности буквой н. (с точкой) по старому названию этой концентрации - нормальность
Пример 8. Сколько граммов сульфата алюминия нужно взять для приготовления 200 мл 0,5 Н раствора? (В данном случае имеется в виду нормальность по отношению к реакциям полного обмена ионов).
Решение. 0,5 н раствор-- это значит, что в 1 литре раствора растворено 0,5 моль эквивалента вещества.
 г/моль.
г/моль.
Составим пропорцию: 1 л раствора - 0,5·57 г
0,2 л - х г , х = 0,2×0,5×57 = 5,7 г Al2(SO4)3 .
5. Титр (Т) - масса растворенного вещества в 1 мл раствора (г/мл).
 . (6.4)
. (6.4)
Зная эквивалентную концентрацию раствора, титр можно рассчитать по формуле
 . (6.5)
. (6.5)
6. Моляльность (Сm) - количество (моль) растворенного вещества в одном килограмме чистого растворителя (моль/кг).
Пример 9. Найти молярность, нормальность, моляльность и титр раствора H2SO4 с массовой долей кислоты 15 % (r = 1,1 г/мл).
Решение. Чтобы найти молярность и нормальность раствора, надо найти, сколько вещества растворено в 1 л раствора. По уравнению (6.2):
m (1л) = V·r = 1000·1,1= 1100 г 1100 г раствора - 100 %
х г - 15 %
х = (1100·15) / 100 = 165 г (H2SO4).
М(H2SO4) = 98 г/моль ; Мэк(H2SO4)  = 49 г/моль экв.
= 49 г/моль экв.
Следовательно, CМ = m / M = 165 / 98 = 1,68 моль/л.
Сэк = m / Mэк = 165 / 49 = 3,37 моль экв/л.
Титр раствора = m/V = 165 / 1000 = 0,165 г/мл.
Для нахождения моляльности раствора найдем массу H2SO4, приходящуюся на 1000 г H2O. 15%-й раствор - это:
85 г Н2О - 15 г H2SO4
1000 г Н2О - х х = 176,5 г.
Следовательно, Сm = 176,5 / 98 = 1,8 (моль/кг).
Пример 10. Для нейтрализации 42 мл H2SO4 потребовалось добавить 14 мл
0,3 Н раствора щелочи. Определить молярность раствора H2SO4.
Решение.Поскольку согласно закону эквивалентов вещества взаимодействуют в эквивалентных количествах, то можно использовать следующее равенство:
Н1·V1 = Н2·V2 (где Н1 и Н2 - нормальности растворов, а V1 и V2 - объемы). Следовательно,
Н к-ты·42 = 0,3·14; отсюда Н к = (0,3·0,14) / 42 = 0,1 Н.
Поскольку Мэк (H2SO4) = М/2, т.е. 0,5 моль, то молярность (СМ) кислоты составляет 0,1·0,5 = 0,05 моль/л.