Основные свойства ковалентной связи – насыщаемость и направленность.
Насыщаемость и максимальная ковалентность.Из рассмотренных выше механизмов образования связи следует, что с точки зрения метода ВС максимально возможное число ковалентных связей (максимальная ковалентность) определяется не только числом валентных электронов, но и общим числом валентных орбиталей. Так, для элементов первого периода максимальная ковалентность равна 1, для второго периода – четырем, так как валентными являются 4 АО – одна 2s- и три 2р-АО. Элементы третьего периода имеют 9 валентных АО – одну 3s, три 3р и пять 3d, и эта максимальная ковалентность практически не реализуется уже по другим причинам (слишком высока энергия возбуждения нескольких электронов на 3d-орбитали; стереохимические, то есть связанные с геометрией молекул, затруднения).
Ограничение числа химических связей атома, вызванное ограниченным числом валентных электронов и орбиталей, называют насыщаемостью ковалентной химической связи. Это свойство, наблюдаемое экспериментально и определяющее стехиометрию молекул (Н2, НСl – существуют, а Н3, Н2Сl - нет), было получено и при квантово-механических расчетах.
Так, Гейтлер и Лондон при расчете системы Н2 + Н не обнаружили волновых функций, связывающих все 3 атома.
Направленность химической связи и углы между связями, гибридизация.Направленность химической связи определяется направленностью в пространстве всех АО с l > 0. Так как лепестки р-орбиталей расположены под углом 1800, а сами px-, py- и pz-АО расположены под углами 900, то следует ожидать, что такие углы будут и в молекулах. Аналогично дело обстоит с d-орбиталями: лепестки образуют угол 900, а между различными d-АО могут быть углы 1800, 900 и 450. Однако на практике множество молекул имеют другие углы между связями: в H2O – 104,50, в NH3 – 1070, в CH4 – 109,280 и т. д.
Для объяснения углов между связями введено представление о гибридизацииатомных орбиталей, то есть о перемешивании орбиталей с различными орбитальными квантовыми числами с получением гибридных (смешанных) АО. Рассмотрим, например, молекулу BeCl2 методом ВС (рис. 4.5).
2s 2p
 
Ве*
3s
Cl Cl Cl ¾ Ве ¾ Cl
Рис. 4.5.Схема ВС и СФ молекулы BeCl2 |
Атом бериллия в возбужденном состоянии имеет два валентных электрона – на 2s- и на 2р-АО. При этом форма молекулы неопределенна, так как одна из связей (2s - 3р) ненаправленна (s-АО шарообразна, имеет одинаковую электронную плотность по всем направлениям). Однако экспериментально доказано, что дипольный момент молекулы равен нулю; так как дипольные моменты каждой из связей больше нуля, то это говорит о том, что молекула линейна, связи Ве-Cl расположены под углом 1800.
Гибридизация 2s- и 2р-АО атома бериллия может быть изображена схемой (рис. 4.6):
Y
Y1
+ -


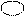











 + + +
+ + +
 | |||||||
 | |||||||
 | |||||||
 | |||||||

 + p
+ p

 s
s
Y2
Исходные 2s- и 2р-АО Ве sp-гибрид-
ные АО
Рис. 4.6.Схема гибридизации s- и р-АО атома Ве
Эта схема соответствует математическому понятию «линейная комбинация атомных орбиталей»:
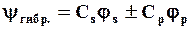
где Сs и Сp – коэффициенты при атомных орбиталях js и jр.
При этом из двух чистых АО (js и jр) образуются две гибридных:
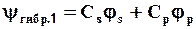 ,
,
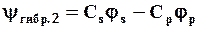 .
.
Аналогично этому возможна гибридизация одной s- и двух р-АО - sр2 , одной s- и трех р-АО – sр3. В случае sр2-гибридизации на атоме образуются три гибридных АО, расположенные под углами 1200 и образующие плоский треугольник, а в случае sр3-гибридизации – четыре АО образуют тетраэдр с углами между ними в 109028/ (рис. 4.7).
Перемешивание АО происходит таким образом, что получается наиболее симметричная фигура; соответственно названию этой фигуры называют и типы гибридизации: sp - линейная (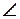 1800), sp2 - треугольная (
1800), sp2 - треугольная (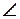 1200), sp3 - тетраэдрическая (
1200), sp3 - тетраэдрическая (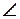 109028'). Имеются и другие типы гибридизации: sp3d2 - октаэдрическая (
109028'). Имеются и другие типы гибридизации: sp3d2 - октаэдрическая (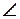 900), sp3d - треугольно-бипирамидальная (
900), sp3d - треугольно-бипирамидальная ( 90 и 1200), sp2d - квадратная (
90 и 1200), sp2d - квадратная ( 90 и 1800) и другие (табл. 4.2).
90 и 1800) и другие (табл. 4.2).
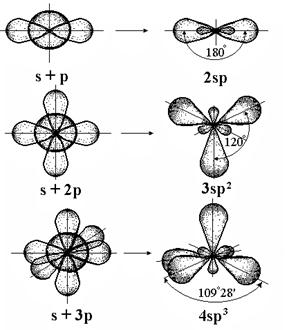
Рис. 4.7. Гибридизация валентных атомных орбиталей
Таблица 4.2
Связь пространственной конфигурации молекул
и ионов с типом гибридизации орбиталей
| Тип гибри- дизации | Пространств. конфигурация молекулы | Тип сое-динений | Примеры |
| sp | линейная | АВ2 | BeF2; HgCl2 |
| sp2 | плоский треугольник | АВ3 | BF3 ; (CО3)2-;SO3 |
| sp3 | тетраэдр | АВ4 | СН4; [Zn(NH3)4]2+ |
| sp2d | квадрат | AB4 | [PdCl4]2- |
| sp3d2 | октаэдр | АВ6 | SF6; [CoF6]3- |
Следует отметить, что в гибридизации участвуют не только АО, имеющие неспаренные электроны, но и АО с несвязывающими электронными парами.Молекулой с несвязывающими электронными парами, участвующими в гибридизации, является, например, молекула Н2О. Схема ВС и структурная формула показаны на рисунке 4.8.
В соответствии с диаграммой ВС у атома кислорода имеет место гибридизация sр3-типа. Углы между электронными облаками должны быть 109028/ . Однако на самом деле углы искажаются вследствие не равноценности облаков (см. далее - метод ОЭПВО), и угол НОН составляет 104,50 .
гибридные АО
 |

 2s 2p
2s 2p


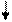
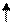
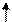



 О •• О:
О •• О:






Н Н
1s 1s
Н H
Рис. 4.8.Схема ВС и структурная формула молекулы Н2О
| гибридные АО 2s 2p В* 2p 2s F F F F- Рис 4.9.Схема ВС иона BF4- |
Примером участия в гибридизации пустой орбитали является молекулярный ион BF4-. Его образование можно пред-
ставить уравнением
BF3 + F- = [BF4]- ,
причем четвертая связь В-F образуется за счет донорно-акцепторного взаимодействия
(В - акцептор и F- - донор,
рис. 4.9).
В гибридизации участвуют все валентные атомные орбитали
бора, то есть имеет место sp3-гибридизация орбиталей атома бора. Молекулярный ион имеет тетраэдрическое строение, причем все углы равны, несмотря на отличие одной из связей по механизму образования (см. далее – делокализация химических связей).
Типы и степень перекрывания АО соседних атомов. Кратные связи.Основываясь на чисто электростатических соображениях, можно предполагать, что энергия связи будет тем больше, чем плотнее и меньше будет электронное облако, притягивающее соседние ядра (первое правило). Это подтверждается и квантово-механическими расчетами. Кроме того, выявляется, что энергия притяжения атомов убывает для следующих типов перекрывания АО одной оболочки:
s-s > s-p > p-p > p-d........
Это связано с тем, что энергии АО и размеры электронного облака возрастают с увеличением квантового числа l (первое правило).
Различают такое перекрывание и соответствующие ему типы связей по элементам симметрии, которые характеризуются молекулярными квантовыми числами l = 0, 1, 2.... и которые обозначают, подобно атомным квантовым числам l , символами, s, p и d (аналоги s, p и d).
Второе правило, определяющее возможность образования связи, состоит в том, что перекрывающиеся АО должны быть одинаковой симметрии относительно оси связи. Так, например, перекрывание s- и р-АО
может привести к образованию связи , если р-АО вытянута вдоль оси связи (рис. 3.10, а), и не образуется, если р-АО перпендикулярна линии связи (рис. 3.10, вариант б).
+
+ -
Рис. 4.10.Схема перекрывания АО - симметричного (а) и несимметричного (б) -относительно линии связи х |
Третье правило: для образования прочной связи необходимо, чтобы перекрывающиеся атомные орбитали были как можно ближе по энергии. Поэтому-то рассматривают участие в образовании химических связей только валентных электронов.
Таким образом,s-связями(перекрыванием) называют связи (перекрывание), образующиеся при перекрывании АО, имеющих цилиндрическую симметрию относительно линии связи (знак и величина волновой функции не изменяются при повороте на любой угол), рис. 3.11.

Перекрывание s + s s + p
Тип связи (а) sss (связ.) (б) ssp(связ.)

(г) рх + рх sрр (связ.) (д) pу + рypрр(связ.)

(е) py + dyppd(связ.)
Рис. 4.11.Некоторые типы перекрывания АО, формы и типы
химических связей







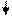

 3p
3p





 + х (а)
+ х (а)
 +
+


 х (б)
х (б)