Диссоциация кислот, оснований и солей.
В соответствии с теорией электролитической диссоциации С. Аррениуса кислоты в водных растворах диссоциируют на ионы Н+ и соответствующие анионы; основания - на ионы ОН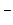 и катионы; соли - на анионы и катионы. Сила любого электролита определяется степенью диссоциации a или связанной с ней константой диссоциации Кд (см. формулы 6.15 и 6.17). При этом сила электролита зависит и от концентрации. Для обычных концентраций (примерно 0,1 М) сильными будут электролиты с a » 1, с учётом ассоциации ионов при aкаж
и катионы; соли - на анионы и катионы. Сила любого электролита определяется степенью диссоциации a или связанной с ней константой диссоциации Кд (см. формулы 6.15 и 6.17). При этом сила электролита зависит и от концентрации. Для обычных концентраций (примерно 0,1 М) сильными будут электролиты с a » 1, с учётом ассоциации ионов при aкаж > 0,7 величина с Кд > 5·10-2.
> 0,7 величина с Кд > 5·10-2.
Диссоциация многоосновных кислот и многокислотных оснований происходит ступенчато, причем константа и степень диссоциации в каждой ступени обычно уменьшаются на 3¸7 порядков, так что часто можно учитывать лишь диссоциацию по 1-й ступени:
1.  H3PO4 H2PO4- + H+ К1 = 7,4×10-3 ;
H3PO4 H2PO4- + H+ К1 = 7,4×10-3 ;
2.  H2PO4- НPO42- + H+ К2 = 6,3×10-8 ;
H2PO4- НPO42- + H+ К2 = 6,3×10-8 ;
3.  НPO42- PO43- + H+ К3 = 4,4×10-13.
НPO42- PO43- + H+ К3 = 4,4×10-13.
Растворимые средние соли (Na2CO3, NaCl, K2SO4 и др.) - обычно сильные электролиты и диссоциируют в воде нацело. Например:
Na2CO3 = 2Na+ + CO32- .
Кислые соли диссоциируют по первой ступени на катион металла и гидроанион:
 NaHCO3 Na+ + HCO3- ,
NaHCO3 Na+ + HCO3- ,
основные соли - на гидроксокатион и анион:
 MgOHCl MgOH+ + Cl- .
MgOHCl MgOH+ + Cl- .