Эквиваленты окислителей и восстановителей
При вычислении эквивалентов элементов и их соединений уже указывалось, что их значения определяются характером превращений, которые они претерпевают в химических реакциях. Это положение сохраняет свою силу при вычислении эквивалентов окислителей и восстановителей, поскольку окислительно-восстановительный процесс очень часто протекает различно в зависимости от концентрации окислителя или восстановителя, температуры, среды и т.д.
Эквивалентная масса окислителя и восстановителяопределяется делением молярной массы на изменение степени окисления (на 1 моль вещества) в рассматриваемой реакции.
Например, действуя в качестве восстановителя, HI окисляется солями железа (III) до элементарного йода по реакции
2HI + 2FeCl3 = I2 + FeCl2 + 2HCl.
2I- = I2 , Dw = 2,
Fe3+ = Fe2+ , Dw = -1.
В этой реакции показатель эквивалентности (Z) восстановителя равен 1 (на 1 моль НI), а его эквивалентная масса Мэк =  . = 128 (г/моль).
. = 128 (г/моль).
Если же к раствору НI добавить избыток хлорной воды, что приведет к образованию иодноватистой кислоты по реакции:
HI + 3Cl2 + 3H2O = HIO3 + 6HCl
I- + 3H2O - 6ē = HIO3 + 5H+ ,
Cl2 +2ē = 2Cl- ,
то показатель эквивалентности восстановителя равен 6, то есть
Мэк = = 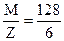 = 21,3 (г/моль).
= 21,3 (г/моль).
Пример 9.Определить эквивалентные массы окислителя и восстановителя в реакции :
+6 +4 +3 +6
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
Решение.Окислителем в этой реакции является K2Cr2O7, а восстановителем - Na2SO3.
Cr2O72- + 14Н+ + 6ē = = 2Cr3+ + 7Н2О,
SO32- + Н2О - 2ē = SO42- + 2Н+ .
Отсюда  г/моль.
г/моль.
 г/моль.
г/моль.