Реакции присоединения
Углеводороды
Лекция № 13
· Химические свойства алкинов. Каталитическое гидрирование (полное и частичное). Реакции электрофильного присоединения: взаимодействие с галогенами, галогеноводородами. Реакции нуклеофильного присоединения: взаимодействие со спиртами, карбоновыми кислотами, циановодородом, восстановление натрием в аммиаке, реакции с аминами и амидами. Гидратация алкинов (реакция Кучерова) и понятие о кето-енольной таутомерии. Окисление. Полимеризация алкинов.
· Особенности тройной углерод-углеродной связи в сравнении с двойной.
Химические свойства алкинов определяются наличием в молекуле тройной углерод- углеродной связи. Наиболее характерны для алкинов, как и для алкенов, реакции присоединения, которые проходят ступенчато.
Гидрирование
Гидрирование алкинов на гетерогенном катализаторе (см. раздел «Алкены») происходит аналогично реакции алкенов и приводит всегда к насыщенным производным, т.е. тройная связь восстанавливается до одинарной.

Присоединение двух молекул водорода происходит последовательно, однако промежуточно образующийся алкен невозможно выделить в условиях реакции, т.к. его гидрирование происходит быстрее, чем гидрирование исходного алкина.
Получение алкенов гидрированим ацетиленовых углеводородов может быть проведено при восстановлении алкинов натрием в жидком аммиаке или водородом над катализатором Линдлара (специальным образом приготовленный палладиевый катализатор).

Парциальное гидрирование протекает стереоспецифично. Гидрирование в жидком аммиаке всегда приводит к транс-, а на катализаторе Линдлара – к цис-производным.
Реакции электрофильного присоединения. Тройная углерод-углеродная связь состоит из одной s- и двух p-связей. p-Электронная плотность в пространстве между двумя sp-гибридизованными атомами углерода выше, чем в алкенах. Учитывая известные свойства алкенов (см. выше), может быть сделано предположение, что алкины в реакциях электрофильного присоединения будут более реакционоспособны, чем алкены. Однако экспериментальные данные показывают, что в большинстве случаев тройная связь менее активна в реакциях электрофильного присоединения, чем двойная. Этот факт может быть объяснен следующим образом:
1) p-электроны тройной связи в значительно большей степени, чем в алкенах, втянуты в пространство между ядрами углерода и прочнее удерживаются ими. Электрофилу сложнее атаковать p-электроны алкина, чем алкена;
2) взаимодействие алкина с электрофилом приводит к образованию не алкильного, а винильного карбокатиона. Положительный заряд последнего сосредоточен на sp2-гибридизованном атоме углерода. Электроотрицательность sp2-углерода выше, чем у sp3, что дестабилизирует промежуточно образующийся карбокатион, затрудняя реакцию.
Присоединение галогенов. Хлор и бром последовательно, в две стадии, присоединяются к тройной связи с образованием сначала дигалогеноалкена, а затем тетрагалогеноалкана. Тщательный подбор условий позволяет либо остановить реакцию на стадии непредельного дигалогенопроизводного (эквимолярное соотношение реагентов и низкая температура), либо получать тетрагалогеноалканы (избыток галогена и повышенная температура).

Первая стадия присоединения протекает преимущественно как анти-присоединение, приводя к транс-алкенам. Реакция с бромом может быть использована как качественная реакция на тройную связь, поскольку в ходе присоединения происходит обесцвечивание бромной воды.
Присоединение галогеноводородов. Присоединение галогеноводородов к алкинам протекает в две стадии. На первой присоединение к тройной связи идет значительно медленнее, чем аналогичное присоединение галогенов. Причины такого поведения алкинов были объяснены ранее. Реакции значительно ускоряются при использовании в качестве катализатора солей двухвалентной ртути или одновалентной меди.

Обе реакции, как и в ряду алкенов, протекают через наиболее устойчивый промежуточный карбокатион. Поэтому в результате образуются гем-дигалогенопроизводные алканов.
Гидратация алкинов (реакция М.Г. Кучерова, 1881 г.). Присоединение воды к ацетиленам разительно отличается от аналогичной реакции в этиленовом ряду. Взаимодействие протекает только в водном растворе кислоты в присутствии солей двухвалентной ртути и приводит к образованию карбонильного соединения, а не соответствующего спирта. Так, гидратация ацетилена приводит к ацетальдегиду.

Механизм реакции Кучерова:

1) Ион двухвалентной ртути взаимодействует с тройной связью, оттягивает к себе часть p-электронов, уменьшая электронную плотность в пространстве между sp-гибридизованными атомами углерода и создавая возможность атаки тройной связи нуклеофильным реагентом – водой.
2) Вода атакует позитивированную ртутью тройную связь, образуя связь С-О за счет одной из своих свободных пар электронов, с образование оксониевого катиона.
3) Протон отщепляется от катионного центра и происходит превращение ртутного производного в непредельный спирт.
4) Таутомерное превращение непредельного (винилового) спирта в карбонильное соединение.
Промежуточно образующиеся в ходе гидратации алкинов виниловые спирты имеют общее название – енолы (ен- указывает на наличие двойной связи, ол- - на гидроксильную группу спирта).
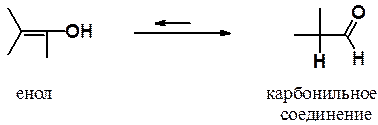
Енол и карбонильное соединение – изомеры, отличающиеся расположением пары p-электронов, атома водорода и находящиеся в равновесии. Такие изомеры называются таутомерами, а само явление – таутомерией.
Образующийся в ходе гидратации алкина енол не удается выделить, поскольку таутомерное равновесие всегда сильно сдвинуто в стороны кето-формы.
Перегруппировка енола в кето-форму протекает вследствие высокой полярности связи О-Н, что приводит к легкому отщеплению протона гидроксильной группы.

Далее протон может присоединиться либо обратно к кислороду енолят-аниона, либо к углероду. Если он присоединится к углеродному атому, то образуется менее кислое соединение, в котором протон не демонстрирует выраженное стремление к диссоциации. Так в реакционной смеси накапливается кето-форма.
Есть единственный случай, когда в реакции Кучерова образуется альдегид – гидратация самого ацетилена. Во всех других реакциях получаются кетоны.

Гидратация пропина приводит к ацетону, а не к пропионовому альдегиду.
Реакции нуклеофильного присоединения. Алкины способны в присутствии катализатора присоединять нуклеофильные реагенты. В результате образуются винильные производные разных классов. Эти реакции называют реакциями винилирования.
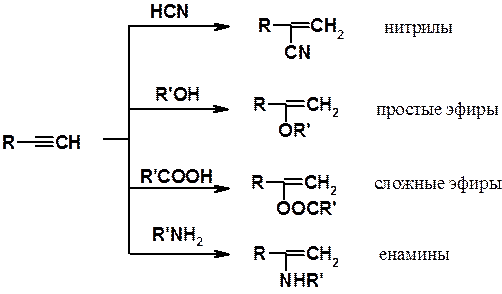
Некоторые реакции нуклеофильного присоединения к алкинам показаны выше. Они часто используются для получения соединений, служащих мономерами в синтезе ВМС. Например, реакция ацетилена с н-бутанолом приводит к бутилвиниловому эфиру, полимеризацией которого получают винилин (бальзам Шостаковского) - ценное лекарственное средство.

Окисление. Как все органические соединения, содержащие кратные углерод-углеродные связи, алкины легко подвергаются окислению самыми различными окислителями, например перманганатом или дихроматом калия. Реакция протекает с полным разрывом тройной связи и образованием карбоновых кислот (алкины с концевой тройной связью образуют карбоновую кислоту и углекислый газ).

Эти реакции могут быть использованы для определения строения алкинов.
Некоторые окислители, например диоксид селена, позволяют проводить селективное окисление алкинов, в ходе которого происходит расщепление только p-связей. При этом дизамещенные алкины превращаются в a-дикетоны, а монозамещенные - в a-кетокислоты.
Полимеризация алкинов. В ряду алкинов наибольший интерес представляют реакции ди-, тримеризациии, а также циклотри- и циклотетрамеризации.
Линейные ди- и тримеры ацетилена, имеющие большое промышленное значение, могут быть получены в присутствии солей одновалентной меди.

Винилацетилен является исходным соединением для синтеза хлоропрена (2-хлорбутадиена-1,3), полимеризацией которого получают хлоропреновый каучук.
Циклотримеризация ацетилена, приводящая к бензолу, была открыта в 1866 г. М.Бертло и модифицирована Н.Д. Зелинским и Б.А. Казанским (1922 г.).

Циклотетрамеризация открыта В. Реппе (1949 г.).
