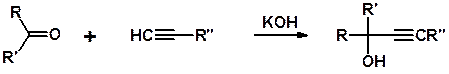Кислотные свойства, образование ацетиленидов
Химические свойства алкинов
По Бренстеду-Лоури кислота – соединение, способное отдать протон (Н+), а кислотность – мера склонности кислоты к такому процессу. Высокая кислотность характерна для веществ, в которых водород связан с сильно электроотрицательным атомом, чаще всего с кислородом, галогеном, серой, азотом. В этом случае электронная плотность связи сильно сдвинута в сторону гетероатома, что приводит к легкому отщеплению протона. Кроме того, электроотрицательный элемент после отщепления протона лучше удерживает пару электронов, что приводит к увеличению стабильности образующегося аниона и, следовательно, к большей кислотности. При рассмотрении электроотрицательности в ряду F > O > N > C не вызывает удивления, что HF - достаточно сильная кислота, H2O значительно слабее, NH3 чрезвычайно слабая, а СН4 вообще не считают кислотой, поскольку нет оснований, способных оторвать протон от алкана.
Как сам ацетилен, так и его гомологи с концевой тройной углерод-углеродной связью являются слабыми СН-кислотами, способными быть донорами протона при взаимодействии с сильными основаниями. Например, в реакции ацетилена с металлическим натрием или амидом натрия образуется ацетиленид натрия.
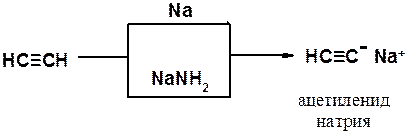
Алкины проявляют кислые свойства только в апротонных безводных растворителях. Это объясняется тем, что кислые свойства ацетиленовых углеводородов с концевой тройной связью выражены значительно слабее, чем у воды, а связь углерод-металл ближе к ионной, чем к ковалентной. Вода мгновенно гидролизует ацетилениды щелочных металлов.
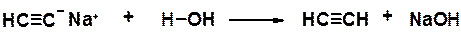
Связь С-Н в алкинах образована за счет перекрывания 1s электрона атома водорода и орбитали углерода, находящегося в sp-гибридизованном состоянии. Такой углеродный атом проявляет большую электронную акцепторность, чем sp2- и sp3-гибридизованные атомы и лучше удерживает электроны. В сравнении с sp3-орбиталью, sp-орбиталь обладает более выраженным s характером: она меньше по размеру (см. Введение) и электрон лучше удерживается атомом. В результате ацетиленид-анион, пара электронов которого находится на sp-орбитали, обладает большей относительной устойчивостью (имеет меньшую энергию), чем винильный или алкильный катион.

Кроме ацетиленидов щелочных металлов в синтезе часто используют магниевые производные, получаемые реакцией алкинов с реактивами Гриньяра (реактивы Ж.Иоцича).

Во многих случаях реактивы Иоцича более удобны в синтезе, чем ацетилениды щелочных металлов. Обладая высокой реакционной способностью, они заметно более устойчивы, с ними проще проводить реакции.
Алкины с концевой тройной связью могут реагировать с ионами тяжелых металлов с образованием соответствующих ацетиленидов. Так, ацетилен и его гомологи реагируют с аммиачным раствором оксида серебра или хлорида одновалентной меди с образованием соответствующих ацетиленидов.

В ацетиленидах тяжелых металлов связь металл-углерод намного менее полярна, чем в производных щелочных металлов. Эти соединения в водных растворах выпадают в осадок. Образование осадка ацетиденида серебра или меди часто используют как качественную реакцию на концевую тройную связь. Если тройная связь находится в глубине цепи, образования ацетиленида (выпадение осадка) не происходит. При работе с ацетиленидами тяжелых металлов следует соблюдать особые меры предосторожности, поскольку эти вещества взрывоопасны.
Реакция с карбонильными соединениями. Ацетилен, как и алкины с концевой тройной связью, в присутствии щелочей реагируют с карбонильными соединениями (альдегидами и кетонами) с образованием ацетиленовых спиртов. Взаимодействие ацетилена с ацетоном (реакция Фаворского):