Электронная конфигурация и гибридизация углерода в органических соединениях
В основном состоянии атом углерода имеет следующую электронную конфигурацию:
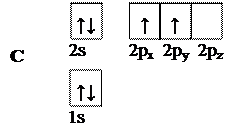 |
Рис. 3. Электронная конфигурация атома углерода в основном состоянии
Углерод в такой конфигурации не может образовывать четыре одинаковых ковалентных связи (см. лекцию 1).
Для объяснения четырехковалентности углерода в органических соединениях используют концепцию гибридизации (Л. Полинг, 1931 г.). Согласно этой концепции:
· один из электронов 2s-орбитали переходит на свободную 2р-орбиталь, образуя систему с четырьмя неспаренными электронами;
· 2s- и три 2p-орбитали смешиваются с образованием четырех эквивалентных sp3-гибридных орбиталей.

Рис. 4. sp3-Гибридные орбитали углерода
Используя концепцию гибридизации, построим простейшую органическую молекулу – метан. В результате перекрывания четырех гибридных sp3-орбиталей атома углерода и s-орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана. При такой геометрии все связи эквивалентны, а молекула обладает минимальной энергией.

Рис. 5. Тетраэдрическая модель метана
Из рис. 5 отчетливо видно, что ковалентные связи, в отличие от ионных, обладают направленностью. Ковалентная связь образующаяся за счет перекрывания орбиталей вдоль линии, связывающей центры соединяющихся атомов, называется s-связью (s – сигма). Она обладает круговой симметрией – при повороте связанных фрагментов относительно линии, связывающей центры атомов, энергия связи не меняется. Из s-связей построены насыщенные углеводороды и углеводородные фрагменты их функциональных производных. Длина С-Н связи 0,11 нм (1,1 Å), энергия – 417 кДж/моль (102 ккал/моль). Длина С-С связи 0,154 нм (1,54 Å), энергия – 347,5 кДж/моль (83 ккал/моль).
В этилене атомы углерода связаны между собой двойной связью. Углероды находятся в sp2-гибридизованном состоянии. Две 2p- и одна 2s-орбитали смешиваются с образованием трех одинаковых sp2-гибридных орбиталей. Формы sp2- и sp3-орбиталей одинаковы. В этом случае гибридные орбитали расположены в одной плоскости под углом 120о (рис. 6). Тригональное (плоскостное) расположение гибридных орбиталей наиболее энергетически выгодно. Каждый из углеродов использует две sp2-орбитали для образования двух s-связей С-Н и одну sp2-орбиталь для образования С-С s-связи.

Рис. 6. sp2-Гибридизованный углерод (a), перекрывание 2p-орбиталей (b)
и молекула этилена (с)
Не участвующая в гибридизации 2р-орбиталь расположена перпендикулярно плоскости. Боковое перекрывание негибридизованной 2р-орбитали одного углеродного атома с соответствующей орбиталью другого углерода приводит к образованию p-связи. Эта связь состоит из двух частей: одно электронное облако расположено над, другое - под плоскостью, в которой лежат атомы.
Двойная С=С связь – комбинация s- и p-связей. Длина С=С связи 0,134 нм (1,34 Å), общая энергия – 607,1 кДж/моль (145 ккал/моль). Вычитая из общей энергии известную энергию одинарной s-связи можно получить энергию p-связи:
607,1 кдж/моль - 347,5 кдж/моль = 259,6 кдж/моль (62 ккал/моль)
p-Связь имеет меньшую энергию и, следовательно, менее прочна, чем сигма.
В простейшем соединении с тройной связью – ацетилене - оба углерода находятся в sp-гибридизованном состоянии. Эквивалентные гибридные орбитали расположены на одной прямой (линейное или дигональное расположение), проходящей через ядро углерода. При образовании тройной углерод-углеродной связи гибридные орбитали образуют две s-связи. Две негибридизованные р-орбитали за счет бокового перекрывания образуют две p-связи в двух взаимно перпендикулярных плоскостях (рис. 7).

Рис. 7. sp-Гибридизованный атом углерода
Таким образом, тройная связь построена из двух p- и одной s-связи. Ее энергия - 829 кДж/моль (198 ккал/моль). Поскольку энергия С=С связи известна, энергия третьей связи может быть определена – 222 кДж/моль (43 ккал/моль). Длина тройной связи – 0,12 нм (1,2 Å).