Кинетика ферментативных реакций.
Уравнение Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата.
 Maud Menten
1879 - 1960
Maud Menten
1879 - 1960
|  Leonor Michaelis
1875 - 1949
Leonor Michaelis
1875 - 1949
|
В 1903, французский биофизик Victor Henri обнаружил, что ферментативная реакция инициируется после связывания фермента и субстрата. Эта работа была взята за основу немецким биохимиком Михаэлисом (Leonor Michaelis) и канадским физиологом Ментен (Maud Menten) (кстати, первая женщина, получившая докторскую степень по медицине), которые изучали кинетику механизма ферментативной реакции инвертазы при гидролизе сахарозы на фруктозу и глюкозу. В 1913 ими была предложена математическую модель ферментативной реакции. Они основывались на том, что субстрат [S] взаимодействует с ферментом [E] с образованием фермент-субстратного комплекса [ES] который после преобразования распадается на продукт [P] и фермент. Понятие константы Михаэлиса было внесено в 1925 году английским ботаником Бригсом (G. E. Briggs) и британским генетиком Холдейном (J. B. S. Haldane), так как в модели Михаэлиса-Ментен не учитывалась константа скорости распада [ES] с образованием продукта. В настоящее время математическая модель реакции выглядит следующим образом:

где k1, k-1 и k2 обозначены как констатны скорости. Авторы считали, что образование и распад фермент-субстратного комплекса вполне обратимый процесс. Скорость ферментативной реакции определяется скоростью распада фермент-субстратного комплекса:
V0 = k2[ES]
Практическим путём определить экспериментально уровень [ES] весьма затруднительно, поэтому необходимо было найти альтернативный способ его определения. Для этого были применены некоторые вводные:
· [Et] – общий уровень фермента участвующий в реакции на данный момент (сумма свободного и связанного с субстратом фермента). Тогда концентрация свободного фермента ровна [Et] - [ES].
· так как [S] обычно значительно превосходит концентрацию фермента [Et], можно пренебречь количеством субстрата связанного с ферментом в каждый данный момент реакции.
Расчёт имеет несколько этапов:
1 этап. Скорость образования фермент-субстратного комплекса можно представить используя константы скорости синтеза (k1) и распада (k-1 и k2) фермент-субстратного комплекса:
(Образование) ES = k1([Et] - [ES])[S]
(Распад) ES = k-1[ES] + k2[ES]
2 этап. Начальные этап каталитической реакции характерен наличием постоянной концентрации фермент-субстратного комплекса [ES] (распад равен синтезу) т.е. состояния равновесия. Следовательно можно объединить два предыдущих уровнения:
k1([Et] - [ES])[S] = k-1[ES] + k2[ES]
3 этап.Необходимо провести алгеброические преобразования – разделить обе части уравнения на [ES], получится:
k1[Et][S] - k1[ES][S] = (k-1 + k2)[ES]
Перенесём k1[ES][S] в левую часть уравнения и вынесем за скобки [ES], получим:
k1[Et][S] = (k1[S] + k-1 + k2)[ES]
Решим уравнение, определив [ES]:

Упростим уравнение разделив числитель и знаменатель на k1:

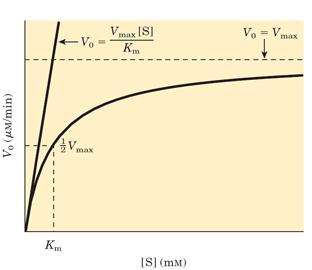
Полученное соотношение суммы констант скорости распада к константе скорости синтеза [ES] – (k2 + k-1)/k1 получило название константа Михаэлиса (Km).

Этап 4.Полученный результат вносимв уравнение определения скорости ферментативной реакции:

Если принять во внимание, что максимальная скорость реакции Vmax возможна при условии полного насыщения фермента субстратом, т.е [ES] = [Et], то Vmax может быть представлена как k2[Et]. Подставив это в уравнение получаем уравнение Михаэлиса-Ментен как оно выглядит в наши дни:

В классическом виде вместо Km стоял коэффициент диссоциации Kd (Kd= k-1/k1) так как авторы основывались на уравнении: k1[E][S] = k-1[ES]. А Лайнвивер и Бэрк внесли новое усовершенствование в уравнение - k1[E][S] = k-1[ES] + k2[ES]