Зависимость удельной и эквивалентной электропроводностей от от концентрации для слабых и сильных электролитов.
Кривые зависимостей 
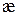 от концентраций имеют максимум (рис.4а.). Концентрационную зависимость удельной электропроводности
от концентраций имеют максимум (рис.4а.). Концентрационную зависимость удельной электропроводности 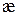 слабых и сильных электролитов определяют два фактора. Для сильных электролитов – это концентрация раствора и подвижность ионов. С увеличением концентрации
слабых и сильных электролитов определяют два фактора. Для сильных электролитов – это концентрация раствора и подвижность ионов. С увеличением концентрации 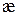 увеличивается, а подвижность ионов уменьшается. При небольших концентрациях растворов электролитов превалирующим является первый фактор – концентрация, что приводит к росту
увеличивается, а подвижность ионов уменьшается. При небольших концентрациях растворов электролитов превалирующим является первый фактор – концентрация, что приводит к росту 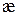 с ростом С. В более концентрированных растворах, главным фактором становиться подвижность ионов, которая уменьшается с концентрацией и значения удельной электропроводности так же снижаются.
с ростом С. В более концентрированных растворах, главным фактором становиться подвижность ионов, которая уменьшается с концентрацией и значения удельной электропроводности так же снижаются.
 |
Для слабых электролитов на концентрационную зависимость
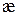 так же влияют два фактора: концентрация (С) и степень диссоциации (
так же влияют два фактора: концентрация (С) и степень диссоциации (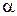 ). Для разбавленных растворов, так же как и для сильных электролитов, главным фактором в этом случае, является концентрация и с увеличением значений С удельная электропроводность увеличивается. Для концентрированных растворов, основным фактором уже становится влияние степени диссоциации (
). Для разбавленных растворов, так же как и для сильных электролитов, главным фактором в этом случае, является концентрация и с увеличением значений С удельная электропроводность увеличивается. Для концентрированных растворов, основным фактором уже становится влияние степени диссоциации (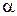 ), и так как с увеличением концентрации (
), и так как с увеличением концентрации (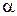 ) уменьшается (рис.4а), то уменьшается и удельная электропроводность.
) уменьшается (рис.4а), то уменьшается и удельная электропроводность.
Эквивалентная электропроводность слабых и сильных электролитов увеличивается с разбавлением (рис. 4 б). Для слабых электролитов это обусловлено в основном тем, что с увеличением разведения степень диссоциации электролита возрастает и в пределе стремится к 1. Рост эквивалентной электропроводности сильных электролитов связан в основном с увеличением подвижностей ионов. В области сильно разбавленных растворов подвижности ионов достигают своего предельного значения.
С позиций теории Дебая-Гюккеля уменьшение подвижности ионов с ростом концентрации обусловлено двумя эффектами торможения движения ионов за счёт электростатического взаимодействия между ионом и ионной атмосферой (рис.5,6.)
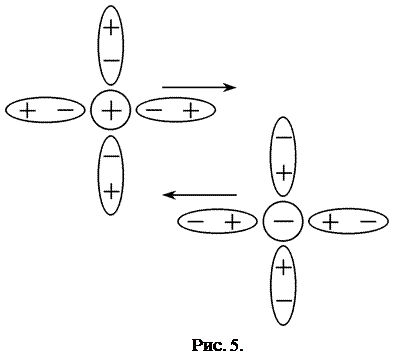 |
1) Эффект электрофоретического торможения обусловлен торможением движения центрального иона встречным движением ионной атмосферы и имеет гидродинамическую природу. Поскольку ионы гидратированы, то движение центрального иона происходит не в неподвижной среде, а в среде, перемещающейся ему навстречу. Движущийся ион находится под влиянием дополнительной тормозящей силы (силы электрофоретического торможения), что приводит к снижению скорости его движения. (рис.5.)
2) Эффект релаксационного торможения. Ионная атмосфера обладает сферической симметрией до тех пор, пока отсутствует внешнее электрическое поле. Как только центральный ион начинает движение под действием электрического поля, симметрия ионной атмосферы нарушается. Перемещение иона сопровождается разрушением ионной атмосферы в одном положении иона и формированием ее в другом, новом. Этот процесс происходит с конечной скоростью в течение некоторого времени, называемого временем релаксации. В результате ионная атмосфера теряет центральную симметрию и позади движущегося иона всегда будет находиться некоторый избыток заряда противоположного знака, что и
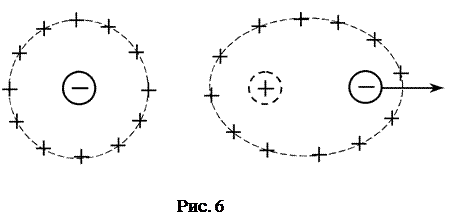 |
вызывает уменьшение его скорости движения. (рис.6.)
И только теория Дебая-Гюкеля-Онзагера позволила количественно учесть влияние этих эффектов на величину эквивалентной электропроводности раствора электролита. Теоретически было получено уравнение
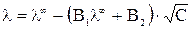 ,
,
в котором постоянные (В1·λ∞) и В2 характеризуют влияние релаксационного и электрофоретического эффектов соответственно. Если концентрация в растворе стремиться к нулю С → 0 эти эффекты практически не проявляются и 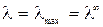 .
.