В равных объемах различных газов при одинаковых условиях
(t0С , P) содержится одно и то же число молекул.Законсформулирован итальянским физиком Авогадро в 1811г и имеет ряд следствий.
Следствие 1. В одном моле вещества содержится 6, 02 ∙10 23 молекул.
Значение 6, 02 ∙ 10 23 моль –1 называют числом
Авогадро(NA).
Следствие 2. Один моль любого газа при нормальных условиях (н.у.)
(00С(273 K), 1,03 . 105 Па) занимает объем 22,4 л/моль.
1 моль О2 (М(О2)=32 г/моль) – содержит 6,02•1023 молекул кислорода, он занимает объем 22,4 л/моль.
1 моль Н2 (М(Н2)=2 г/моль) – содержит 6,02•1023 молекул водорода, он занимает объем 22,4 л/моль.
Задача. Какой объем водорода выделится при травлении 3,25 г Zn соляной кислотой?
Для решения задачи записываем уравнение реакции:
Zn + 2 HCl → ZnCl2 + H2
65 22,4
где 65 – молярная масса цинка; 22,4 – молярный объем водорода.
При травлении 65 г цинка выделится 22,4 л/моль водорода, а при травлении 32,5 г цинка выделится Х л водорода. Найдем объем выделившегося водорода при н.у.
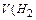 ) = X =
) = X = 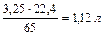
В результате работ немецкого химика Рихтера, английских ученых Дальтона и Волластона (1792 – 1800 г.) были установлены так называемые “соединительные веса” или эквиваленты реагирующих веществ.