Основные положения и направления развития теории химического строения органических веществ А. М. Бутлерова. Изомерия и гомология органических веществ
Органические вещества. Классификация органических веществ
Неорганические вещества. Классификация неорганических веществ
Систематическая номенклатура
Классификация и номенклатура неорганических веществ
Все неорганические вещества делятся на простые и сложные.
1. Простые вещества. Простые вещества образованы атомами одного элемента.
1.1. Металлы (щелочные, щелочноземельные, переходные).
1.2. Неметаллы (галогены – главная подгруппа VII группы, халькогены – главная подгруппа VI группы, пниктогены – главная подгруппа V группы, подгруппа углерода, водород.
1.3. Благородные газы.
Названия простых веществ даются чаще всего по названию соответствующих химических элементов.
Различие в понятиях «химический элемент» и «простое вещество» становиться понятным, когда мы сталкиваемся с явлением существования одного химического элемента в виде нескольких простых веществ – аллотропией. Простые вещества, образованные одним и тем же химическим элементом, называются аллотропными модификациями(видоизменениями).
Причинами аллотропии являются:
– Разное число атомов в молекуле.
Например, элемент кислород существует в виде нескольких аллотропных модификаций – монокислород О; дикислород О2; трикислород (озон) О3; тетракислород О4, отличающихся составом молекул.
– Образование разных кристаллических форм (полиморфизм).
Например, элемент углерод существует в виде нескольких аллотропных модификаций, важнейшими из которых являются алмаз (sp3-гибридизация атомов С), графит (sp2-гибридизация атомов С), карбин (полиин и поликумулен; sp-гибридизация атомов С) и фуллерены, отличающиеся строением кристаллических решеток.
2. Сложные вещества. Сложное вещество (химическое соединение) – это химически индивидуальное вещество, состоящее из атомов различных элементов, химически связанных между собой.
2.1. Бинарные соединения.
2.1.1. Оксиды – это сложные вещества, состоящие из атомов двух элементов, один из которых кислород в степени окисления –2.
Названия оксидов образуются следующим образом: сначала говорят слово "оксид", а затем – название элемента в родительном падеже. Если элемент проявляет переменную валентность, то она указывается римской цифрой после названия в круглых скобках.
– Основные оксиды – это оксиды, которым соответствуют основания: Na2О – оксид натрия; FеО – оксид железа (II).
– Кислотные оксиды – это оксиды, которым соответствуют кислотные гидроксиды (кислородсодержащие кислоты): SO2 – оксид серы (IV); Р2О5 – оксид фосфора (V); Mn2O7 – оксид марганца (VII).
– Амфотерные оксиды проявляют и кислотные, и основные свойства, им соответствуют амфотерные гидроксиды: Al2O3 – оксид алюминия; ZnO – оксид цинка.
– Безразличные, несолеобразующие или индифферентные оксиды не проявляют ни основных, ни кислотных свойств, то есть не образуют солей: СО – оксид углерода (II); NO – оксид азота (II), N2O – оксид азота (I), SiO – оксид кремния (II).
2.1.2. Бескислородные кислоты. (НСl – хлороводородная (соляная) кислота).
2.1.3. Бескислородные соли – соли бескислородных кислот. Названия этих солей строятся с использованием суффикса –ид: Na2S – сульфид натрия; Cu2S – cульфид меди (I), NaCI – хлорид натрия; CuBr – бромид меди (I); SnI2 – иодид олова (II).
2.1.4. Прочие: пероксиды (соединения, содержащие пероксид-ион O22–; –O–O–): Н2О2 – пероксид водорода; Na2O2 – пероксид натрия; нитриды: Li3N – нитрид лития; Сu3N – нитрид меди (I); карбиды: CаС2 – карбид кальция; Аl4С3 – карбид алюминия и другие, например: OF2 – фторид кислорода.
2.2. Гидроксиды – это соединения, содержащие группы ОН, которые связаны с атомами различных элементов.
2.2.1. Кислородсодержащие кислоты – это соединения с общей формулой НxАyOz, где АyOzx– – кислотный остаток и А – кислотообразующий элемент.
Традиционные названия кислот складываются из двух слов: собственно названия данной кислоты, выраженного прилагательным, и группового слова кислота. В собственно названиях кислот для обозначения степени окисления кислотообразующего элемента применяют следующие суффиксы: -н-, -ов- или -ев- (высшая или единственная степень окисления); -новат- (промежуточная степень окисления +5); -(ов)ист- (промежуточные степени окисления +3 и +4); -новатист-(низшая положительная степень окисления +1): НСlO (степень окисления хлора +1) – хлорноватистая кислота, НСlO2 (+3) – хлористая кислота, НСlO3 (+5) – хлорноватая кислота, НСlO4 (+7) – хлорная кислота; HNO3 (степень окисления азота +5) – азотная кислота, HNO2 (+3) – азотистая кислота; Н2SO4 (степень окисления серы +6) – серная кислота, Н2SО3 (+4) – сернистая кислота.
Иногда кислотообразующий элемент в одной и той же степени окисления образует две кислоты. Для названия кислоты, которая содержит меньшее число атомов кислорода (в расчете на один атом элемента) в названии используют приставку мета-, а для названия кислоты с большим числом атомов кислорода используют приставку орто-: НРО3 – метафосфорная кислота, Н3РО4 – ортофосфорная кислота.
2.2.2. Основания (основные гидроксиды) – это соединения, в которых группы ОН соединены с атомами металла.
Для названия оснований вначале называется слово "гидроксид", а затем – название металла в родительном падеже с указанием в круглых скобках римской цифрой валентности, если металл может проявлять переменную валентность: NaOH – гидроксид натрия; Fe(OH)2 – гидроксид железа (II).
2.2.3. Амфотерные гидроксиды – это сложные вещества, проявляющие и кислотные, и основные свойства.
Названия их строятся аналогично названиям оснований: Аl(ОН)3 – гидроксид алюминия; Fe(OH)3 – гидроксид железа (III).
2.3. Соли – это вещества, состоящие из атомов металла и атомов, входящих в состав кислотного остатка. Названия солей бескислородных кислот – см. выше.
2.3.1. Средние соли. Названия средних солей строятся из корней русских или латинских названий кислотообразующих элементов с соответствующим суффиксом и названия металла в родительном падеже.
Если кислотообразующий элемент имеет одну степень окисления, то к корню его названия добавляют суффикс -ат: СаСО3 карбонат кальция.
Если кислотообразующий элемент имеет две степени окисления, то при высшей степени окисления его в название входит суффикс -ат, а при низшей степени окисления – суффикс -ит: CuSO4 – сульфат меди, СuSО3 – сульфит меди.
Если кислотообразующий элемент проявляет несколько степеней окисления, то для высшей степени окисления используют приставку пер- и суффикс -ат; далее (в порядке уменьшения степеней окисления) – суффикс -ат, затем суффикс -ит и, наконец, приставку гипо- и суффикс -ит: AgNO3 – нитрат серебра (I), NaNO2 – нитрит натрия, Na2N2O2 – гипонитрит натрия; КСlO4 – перхлорат калия, NaClO3 – хлорат натрия, Ва(СlO2)2 – хлорит бария, КСlO – гипохлорит калия.
Приставки мета- и орто-, имеющиеся в названиях кислородсодержащих кислот, сохраняются в названиях солей: К3РО4 – ортофосфат калия, КРО3 – метафосфат калия.
2.3.2. Кислые соли (гидросоли). Названия их образуют, добавляя к названию аниона соответствующей средней соли приставку гидро-; если число атомов водорода (в расчете на один анион) больше единицы, то это число указывают в названии с помощью числовой приставки: KHSO4 – гидросульфат калия, Са(Н2РО4)2 – дигидрофосфат кальция.
2.3.3. Основные соли (гидроксосоли). Названия их образуют, добавляя к названию катиона соответствующей средней соли приставку гидроксо-: FeOHNO3 – нитрат гидроксожелеза (II), (СuОН)2СО3 – карбонат гидроксомеди (II).
2.3.4. Смешанные соли – это соли, содержащие два или несколько кислотных остатков. Пример: CaCl2O (Ca(ClO)Cl) – хлорид-гипохлорит кальция.
2.3.5. Двойные соли – это соли, содержанию атомы двух или нескольких металлов. Примеры: КАl(SO4)2 – сульфат алюминия-калия, CsCr(SO4)2 – сульфат хрома-цезия.
2.4. Комплексные соединения – это соединения, в которых формально превышается степень окисления центрального атома.
Классификация и номенклатура органических веществ
В классификации органических веществ принимаются за основу два важнейших признака:
– строение углеродного скелета и
– наличие в молекуле функциональных групп.
Различают следующие типы соединений по строению углеродного скелета:
| Органические вещества | |||||||
| Ациклические | Карбоциклические | Гетероциклические | |||||
| Предельные | Непредельные | Предельные | Непредельные | Ароматические | Предельные | Непредельные | Ароматические |
1. Ациклические (алифатические, соединения жирного ряда) – это соединения, имеющие открытую углеродную цепь (разветвленную или неразветвленную). Например:
СН3–СН2–СН2–СН3 – бутан, 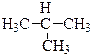 – 2-метилпропан.
– 2-метилпропан.
2. Карбоциклические – это соединения, в которых углеродная цепь замкнута в цикл (кольцо). Например:

3. Гетероциклические – это соединения, содержащие в цикле, кроме атомов С, атомы других элементов. Например:

Карбоциклические и гетероциклические соединения могут быть ароматическими, если наблюдается сопряжение р-электронов и образование циклической p-электронной системы.
В большинстве органических молекул помимо атомов С и Н содержатся атомы других элементов. Именно от них в первую очередь зависят химические свойства вещества. Эти атомы входят в состав функциональных групп, т.е. групп атомов неуглеводородного характера, определяющих принадлежность соединения к определенному классу:
| Функциональная группа | Обозначение функциональной группы в названии вещества | Название класса соединений | Общая формула класса | ||
| приставка | суффикс | ||||
| Карбоксильная –СООН | -овая кислота | Карбоновые кислоты | R–СООН | ||
| Сульфогруппа –SО3Н | сульфо- | -сульфокислота | Сульфокислоты | R–SО3Н | |
| Карбо-нильная | –СНО | оксо- | -аль | Альдегиды | R–СНО |
| =С=О | -он | Кетоны | R–СО–R¢ | ||
| Гидроксильная –ОН | гидрокси- | -ол | Спирты | R–ОН | |
| Фенолы | Аr–ОН | ||||
| Тиольная –SН | меркапто- | -тиол | Тиолы (меркаптаны) | R–SН | |
| Аминогруппа –NН2 | амино- | -амин | Амины | R–NН2 | |
| Нитрогруппа –NО2 | нитро- | – | Нитросоединения | R–NО2 | |
| Алкоксильная –ОR | алкокси- | – | Простые эфиры | R–О–R¢ | |
| Галогены (–F, –Сl, –Вr, –I) | галоген- | – | Галогенопроизводные | R–Hal | |
| У Г Л Е В О Д О Р О Д Ы | |||||
| Двойная связь | – | -ен | Алкены | СnН2n | |
| 2 двойные связи | – | -диен | Алкадиены | СnН2n-2 | |
| Тройная связь | – | -ин | Алкины | СnН2n-2 | |
| Одинарная связь | – | -ан | Алканы | СnН2n+2 |
Органические соединения могут содержать не одну, а несколько функциональных групп.
Для того, чтобы назвать вещество по формуле, необходимо:
1). Выбрать самую длинную цепь атомов углерода, которую можно соединить одной непрерывной линией и которая включает кратные связи и функциональные группы.
2). Пронумеровать эту цепь с того края, к которому ближе кратная связь, углеводородный радикал, функциональная группа. Если в молекуле несколько функциональных групп, то нумеруют от края цепи, к которому ближе самая старшая группа (в таблице функциональные группы даны в порядке убывания старшинства).
3). Ответить на вопросы:

На вопросы 1), 2), 4) и 5) отвечают необходимое число раз.