УПРАЖНЕНИЯ
1. По заданным молекулярным формулам составьте структурные формулы линейных карбоновых кислот и дайте им названия: С3Н6О2, С5Н10О2, С4Н6О2, С8Н8О2, С4Н6О4.
2. Запишите структурную формулу изомера лимонной кислоты:
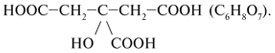
3. Составьте по одной структурной формуле карбоновых кислот разных классов (всего пять), содержащих цикл или имеющих разветвленное строение, с семью атомами С в молекуле. Это могут быть кислоты: а) одноосновные; б) двухосновные; в) предельные; г) непредельные;
д) алифатические; е) ароматические.
4. Приведите структурные формулы карбоновых кислот по их названиям: а) муравьиная кислота; б) бромуксусная кислота; в) п-метоксибензойная кислота; г) изомасляная кислота;
д) щавелевая кислота; е) акриловая кислота; ж) циклопропанкарбоновая кислота.
5. Какая карбоновая кислота получится при окислении: а) п-бромтолуола; б) о-ксилола
[1,2-(СН3)2С6Н4]?
6. Составьте уравнения реакций окисления этиленгликоля НОСН2СН2ОН и малонового альдегидаОНССН2СНО в соответствующие дикарбоновые кислоты.
Химические свойства.
Карбоновые кислоты диссоциируют в водном растворе с отщеплением протонов Н+, обусловливающих кислую среду раствора:

Водные растворы карбоновых кислот изменяют окраску индикаторов и являются электролитами. По сравнению с сильными минеральными кислотами (H2SO4, HNO3, HCl) – это слабые кислоты.
2. Карбоновые кислоты реагируют с активными металлами (примерно от Li до Fe в ряду напряжений металлов), выделяя водород:

3. Кислоты реагируют с основными оксидами:
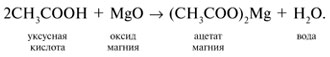
4. Кислоты реагируют с основаниями:
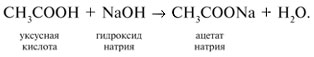
5. Кислоты реагируют с аммиаком на холоду с образованием солей аммония:
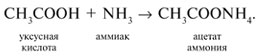
Соли аммония карбоновых кислот термически неустойчивые соединения, при нагревании они отщепляют воду и превращаются в амиды кислот:

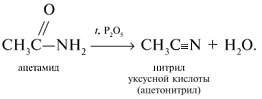
При нагревании амидов с водоотнимающими средствами (например, с пентаоксидом фосфора Р2О5) образуются нитрилы карбоновых кислот:
6. Карбоновые кислоты реагируют с солями более слабых и летучих кислот:

7. Кислоты RCOOH реагируют со спиртами R'OH (реакция этерификации) с образованием сложных эфиров RCOOR'. Это обратимая реакция:

8. Кислоты реагируют с хлоридами фосфора РСl3, РСl5, а также с тионилхлоридом SOCl2, обменивая гидроксильную группу на атом хлора:

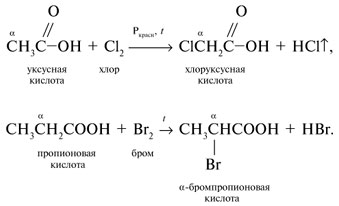
9. Вследствие электроноакцепторного влияния карбоксильной группы СООН атомы водорода при углероде в  -положении довольно подвижные и могут замещаться на атомы хлора или брома:
-положении довольно подвижные и могут замещаться на атомы хлора или брома:
Муравьиная кислота НСООН по химическим свойствам несколько отличается от других карбоновых кислот. Так, для нее неизвестны хлорангидрид и ангидрид. В присутствии водоотнимающих средств (PCl5, SOCl2, H2SO4 (конц.)) муравьиная кислота отщепляет воду с выделением оксида углерода(II):

Из-за наличия в молекуле Н–СООН альдегидного протона муравьиная кислота легко окисляется, в частности дает реакцию «серебряного зеркала»:

Ангидриды карбоновых кислот RC(O)–O–C(O)R получают взаимодействием галогенангидридов с солями карбоновых кислот:

УПРАЖНЕНИЯ.
1.Составьте уравнения реакций бензойной кислоты С6Н5СООН со следующими реагентами:
а) КОН; б) Аl; в) СаО; г) Na2CO3; д) NH3 (водн.). (Реакции протекают с замещением протона карбоксильной группы.)
2. Запишите уравнения реакций бензойной кислоты, в которых происходит расщепление связи
С–ОН в карбоксильной группе. Используйте реагенты: а) РСl5; б) SOCl2; в) пропанол-1 в присутствии минеральной кислоты НСl.
3.Составьте уравнения реакций, с помощью которых изобутановую кислоту (СН3)2СНСООНможно превратить в следующие соединения: а) изобутират натрия (СН3)2СНСООNa;
б) этилизобутират (сложный эфир); в) изобутирилхлорид (СН3)2СНС(О)Сl; г) изобутирамид
(СН3)2СНС(О)NH2.
4. Составьте уравнения реакций: а) декарбоксилирование бензойной кислоты С6Н5СООН до бензола под действием горячего раствора КМnО4; б) восстановление бензольного кольца бензойной кислоты (Н2, Ni, 20 °С, 1 атм) с образованием циклогексанкарбоновой кислоты;
в) бромирование бензойной кислоты в метаположение бензольного кольца под действием Вr2 в присутствии Fe; г) нитрование бензойной кислоты в метаположение при действии смеси концентрированых кислот НNO3/H2SO4.
Источник http://him.1september.ru/article.php?ID=200403505
Д/З . Самостоятельно изучить физические свойства и применение карбоновых кислот. Выполнить упражнения.