Химия на рубеже XVIII и XIX веков (период развития химии как науки об атомах и молекулах)
Лекция № 5
План
1. Работы А.Л.Лавуазье. Новый взгляд на теорию горения.
2. Работы Клода Луи Бертолле.
3. Джон Дальтон и его атомное учение.
4. Дальнейшее развитие химической атомистики. Работы Гей-Люссака и Авогадро.
1.Работы А.Л.Лавуазье (1743 – 1794). Новый взгляд на теорию горения
Антуан Лоран Лавуазье получил юридическое образование, но занимался естественными науками, в том числе и химией. Одной из первых работ по химии были мемуары «О природе воды», в которых он описывал возможности превращения воды в землю (1769 год).
 С 1772 года он занимался опытами сжигания различных веществ, прежде всего фосфора. Он писал: «…я открыл, что сера при горении вовсе не теряет в весе, а напротив, увеличивается, то есть из одного фунта серы можно получить значительно больше, чем один фунт купоросной кислоты….то же самое можно сказать о фосфоре; это увеличение происходит благодаря громадному количеству воздуха, который связывается при горении». Он высказал предположение, что увеличение массы металлов при горении также объясняется поглощением воздуха. Своими опытами опроверг теорию флогистона. Анализируя результаты своих опытов, Лавуазье пришел к выводу, что воздух – не просто тело, как думали многие ученые XVIII века, а смесь различных по свойствам газов. Одна из частей смеси поддерживает горение и « наиболее удобна для дыхания». И, действительно, в 1772 г. – К.Шееле, а в1774 году – Дж. Пристли – открыли кислород. Лавуазье не сразу пришел к открытию кислорода, только после встречи с Пристли в 1774 году он начал опыты с оксидами металлов, например с оксидом ртути (II): 2HgO→2Hg + O2, и в 1777 году открыто выступил против теории флогистона. В одном из мемуаров он писал: «Химики сделали из флогистона смутное начало, которое не определено в точной мере и которое по этому пригодно для любых объяснений, в которое его хотят ввести. Иногда это начало весомо, иногда оно таковым не является; иногда это свободный огонь, иногда это огонь, соединенный с землистым элементом; иногда оно проходит сквозь поры сосудов, иногда они непроницаемы для него. Он объясняет одновременно и щелочность и нейтральность, прозрачность и непрозрачность, окраску и отсутствие окраски; это настоящий Протей, который меняет свой облик каждое мгновение».
С 1772 года он занимался опытами сжигания различных веществ, прежде всего фосфора. Он писал: «…я открыл, что сера при горении вовсе не теряет в весе, а напротив, увеличивается, то есть из одного фунта серы можно получить значительно больше, чем один фунт купоросной кислоты….то же самое можно сказать о фосфоре; это увеличение происходит благодаря громадному количеству воздуха, который связывается при горении». Он высказал предположение, что увеличение массы металлов при горении также объясняется поглощением воздуха. Своими опытами опроверг теорию флогистона. Анализируя результаты своих опытов, Лавуазье пришел к выводу, что воздух – не просто тело, как думали многие ученые XVIII века, а смесь различных по свойствам газов. Одна из частей смеси поддерживает горение и « наиболее удобна для дыхания». И, действительно, в 1772 г. – К.Шееле, а в1774 году – Дж. Пристли – открыли кислород. Лавуазье не сразу пришел к открытию кислорода, только после встречи с Пристли в 1774 году он начал опыты с оксидами металлов, например с оксидом ртути (II): 2HgO→2Hg + O2, и в 1777 году открыто выступил против теории флогистона. В одном из мемуаров он писал: «Химики сделали из флогистона смутное начало, которое не определено в точной мере и которое по этому пригодно для любых объяснений, в которое его хотят ввести. Иногда это начало весомо, иногда оно таковым не является; иногда это свободный огонь, иногда это огонь, соединенный с землистым элементом; иногда оно проходит сквозь поры сосудов, иногда они непроницаемы для него. Он объясняет одновременно и щелочность и нейтральность, прозрачность и непрозрачность, окраску и отсутствие окраски; это настоящий Протей, который меняет свой облик каждое мгновение».
Процесс горения Лавуазье описывает в мемуаре “О горении вообще» (1777г).
1. При всяком горении происходит выделение “огненной материи” и света.
2. Тела могут гореть только в «чистом» воздухе и не могут гореть в пустоте.
3. При всяком горении происходит разрушение или разложение «чистого» воздуха, а вес сгоревшего тела увеличивается на массу поглощенного воздуха.
4. При всяком горении горящее тело превращается в кислоту. (S → H2SO4, C → H2CO3) Кислотообразующее начало он назвал “оксиген” – рождающий кислоту (позднее кислород). Теория кислот не соответствовала фактам,так как в состав соляной кислоты, например, не входит кислород.
Фактически кислород открыл Лавуазье. В 1785 году. у Лавуазье возникала мысль изложить открытые им новые факты и объяснения различных явлений с точки зрения кислородной теории в книге “Элементарный курс химии”. В ней он пишет, что считать, что все вокруг состоит из 3-4 элементов – это предрассудок, перешедший к нам от греческих философов. Описав химические методы познания, отмечает относительность знаний. Так, например, он говорит о простых телах: «Итак, химия идет к своей цели, к своему совершенству., разделяя, подразделяя, и еще подразделяя тела, и мы не знаем, каков будет предел ее успехов. Мы не можем поэтому утверждать, что то, что сегодня признается простым, действительно является простым. Мы можем только сказать, что или иное вещество является лишь пределом делимости посредством химического анализа и что оно не может быть разделено далее при современном состоянии наших знаний». В этом же труде дает определение элемента: «Итак, я скажу, что если названием элементов обозначить простые или неделимые молекулы, составляющие тела, то, вероятно, мы их не знаем; если же, напротив, мы свяжем с названием элементов, или начал, представление о последнем пределе, достигаемом анализом, то все вещества, которые мы еще не смогли никоим образом разложить, являются для нас элементами».
Другой вопрос, который освещен Лавуазье в книге «Элементарный курс химии» - химическая номенклатура. Алхимики часто давали случайные названия веществам. Эта практика сохранялась и потом. В 1768 году Лавуазье организовал при Парижской академии наук номенклатурную комиссию (О – окислитель, H – гидроген, N - безжизненный). Названия сложных веществ – производные от названия простых тел в зависимости от степени окисления.
В «Элементарном курсе химии» приводит классификацию веществ, в которой имеются явные несообразности. Так, к простым веществам, он относит известь, магнезию, барит, глинозем и др.
Появление этого курса в 1789 году означало “химическую революцию” в науке.
Однако, «химическая революция» с выходом и появление кислородной теории горения не завершилась. Ее завершили последующие поколения химиков путем внедрения в химию атомистики.
2.Работы Клода Луи Бертолле (1748 – 1822г.)
Клод Луи Бертолле - один из единомышленников Лавуазье, признавший кислородную теорию горения, в 1785 году. Он разложил NH3 и установил, что он состоит из N2 и H2. В HCN и H2S не обнаружил кислорода и сделал вывод о существовании кислот, несодержащих кислорода. При пропускании хлора через горячую щелочь получил хлорат калия, который позднее был назван в честь него бертолетовой солью:
t
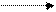 Cl2 + КОН KCl + KClO3 + Н2О
Cl2 + КОН KCl + KClO3 + Н2О
бертолетова соль
Бертолетова соль добавлялась в порох вместо селитры.
Бертолле – автор теории химического сродства.
Силы химического сродства аналогичны ньютоновским силам, но они действуют на более близком расстоянии. Он объяснил условия протекания реакций обмена до конца, рассмотрел случаи образования соединений переменного состава, например, оксидов.
Никто из ученых не опровергал это, кроме Джозефа Луи Пруста (1754-1825).
Многие химики приняли точку зрения Пруста и признали его “закон постоянства состава химических соединений”.
Пруст известен как химик-аналитик. Он автор сероводородного метода группового осаждения металлов.
Позднее было установлено, что правы были оба химика: есть вещества переменного состава (бертоллиды) и постоянного состава (дальтониды).
В начале ХIX века химия встала на путь экспериментального и теоретического развития.