Скорость химической реакции
Классификация химических реакций
Для химических реакций принято несколько классификаций, основанных на критериях молекулярности, порядка, гомогенности, сложности и теплового эффекта.
Молекулярность и суммарный порядок реакции иногда совпадают. В этом случае стехиометрическое уравнение простой реакции соответствует ее механизму.
По агрегатному состоянию взаимодействующих веществ (гомогенности) реакции могут быть разделены на гомогенные и гетерогенные. В гомогенных реакциях участвует одна фаза (газообразная или жидкая). В гетерогенных реакциях принимают участие две или более фаз.
По сложности различают реакции простые и сложные.
Простые реакции:
- необратимые 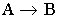
- обратимые 
Сложные реакции:
- параллельные 
- последовательные 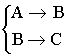
- смешанные 
- (параллельные и
последовательные)
К сложным реакциям можно также отнести цепные реакции.
По тепловому эффекту реакции классифицируют на эндотермические и экзотермические.
Изотермический режим проще всего осуществляется в аппаратах идеального смешения.
Адиабатический режим- отсутствие теплообмена через внешние и внутренние ограждающие поверхности.
Основной величиной в химической кинетике является скорость реакции. Ее можно выразить изменением числа молей (или массы) веществ, участвующих в реакции, в единице объема за единицу времени:
 , (12.1)
, (12.1)
где  - скорость реакции, кмоль(м-3с-1);
- скорость реакции, кмоль(м-3с-1); 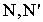 - число молей реагента и продукта, соответственно;
- число молей реагента и продукта, соответственно;  - время, с;
- время, с;  - объем реакционной системы (необходимый объем раствора), м3.
- объем реакционной системы (необходимый объем раствора), м3.
Скорость реакции зависит от свойств взаимодействующих реагентов, концентрации реакционной системы и температуры. Для одной и той же химической реакции только два фактора могут изменяться, а свойства реагентов (теплота, химическая активность и т.д.) остаются теми же.
Следовательно  (температура, концентрация реакционной системы)
(температура, концентрация реакционной системы)
В изотермических условиях:
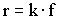 (концентрация реакционной системы)
(концентрация реакционной системы)
Величина  в последнем уравнении - константа скорости реакции (или удельная скорость реакции). В действительности эта константа, согласно закону Аррениуса, является функцией температуры:
в последнем уравнении - константа скорости реакции (или удельная скорость реакции). В действительности эта константа, согласно закону Аррениуса, является функцией температуры:
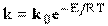 , (12.2)
, (12.2)
где  - константа, характеризующая реакцию (фактор частоты);
- константа, характеризующая реакцию (фактор частоты);  - энергия активации, кДж/кмоль; R - универсальная газовая постоянная, кДж/(кмоль.К); Т - абсолютная температура, при которой происходит реакция, К;
- энергия активации, кДж/кмоль; R - универсальная газовая постоянная, кДж/(кмоль.К); Т - абсолютная температура, при которой происходит реакция, К;
Активные массы, определяющие скорость химической реакции, в случае идеальной системы, можно выразить через концентрации или парциальные давления, в других же случаях- через активности.
Исходя из объема реактора получили:
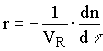 (количество образовавшихся молей/(объем реактора).время), (12.3)
(количество образовавшихся молей/(объем реактора).время), (12.3)
В двухфазных системах, исходя из поверхности контакта фаз имеем:
 ( количество образовавшихся молей/(поверхность контакта).время), (12.4)
( количество образовавшихся молей/(поверхность контакта).время), (12.4)
В реакциях с твердой фазой
 ( количество образовавшихся молей/(масса твердого тела).время), (12.5)
( количество образовавшихся молей/(масса твердого тела).время), (12.5)
В зависимостях (11.3), (11.4), (11.5)  -скорость реакции, кмоль.с-1;
-скорость реакции, кмоль.с-1;  - количество молей вещества, кмоль;
- количество молей вещества, кмоль; 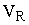 - объем реакционной смеси, м3;
- объем реакционной смеси, м3;  - текущее время, с; S - площадь поверхности контакта взаимодействующих фаз, м2; M- количество вещества, кмоль.
- текущее время, с; S - площадь поверхности контакта взаимодействующих фаз, м2; M- количество вещества, кмоль.
Скорость химической реакции можно записать следующим образом:
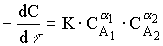 , (12.6)
, (12.6)
Это уравнение называется кинетическим уравнением химической реакции. K - константа скорости реакции, с-1;  - порядки реакции по компонентам
- порядки реакции по компонентам  и
и  .
.
Зависимость скорости реакции от температуры. Из уравнения Аррениуса  следует экспоненциальная зависимость констант скорости реакции от температуры. Скорость реакции становится, таким образом, зависимой от температуры через константу скорости. Характер изменения скоростей химических реакций от температуры зависят от типа реакций. На рисуноке 1 представлено несколько таких случаев.
следует экспоненциальная зависимость констант скорости реакции от температуры. Скорость реакции становится, таким образом, зависимой от температуры через константу скорости. Характер изменения скоростей химических реакций от температуры зависят от типа реакций. На рисуноке 1 представлено несколько таких случаев.
Скорость простых необратимых реакций зависит от температур по уравнению Аррениуса (рисунок 74а).
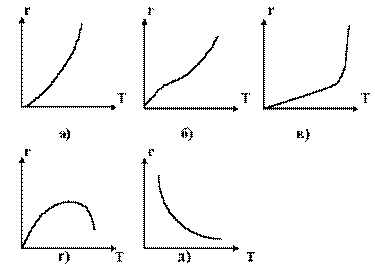
Рисунок 74 -Зависимость скорости реакции от температуры.
Для реакций в гетерогенной системе общая скорость процесса является результатом скоростей химических реакций и скоростей массопередачи. Если массопередача является определяющим этапом гетерогенного процесса, то зависимость от температуры очень мало заметна (рисунок 174б).
Реакции в пламени характеризуются температурой горения, при которой скорость реакции внезапно возрастает до больших значений (рисунок 174в).
Обратимые реакции имеют максимальную скорость при определенных температурах, часто оптимальных. При такой температуре скорость обратной реакции возрастает быстрее, чем скорость прямой реакции, так что общая скорость реакции уменьшается (рисунок 174г).
Кривая такой же формы соответствует обратимым физическим явлениям: например, в случае каталитических реакций обратимым будет процесс адсорбция-десорбция.
Известны несколько случаев, когда скорость реакции понижается с увеличением температуры (рисунок 174д). В качестве примеров могут служить окисление окиси азота и углеводов.