ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
План лекции: Термодинамическое определение внутренней энергии, энтальпии, теплоты и работы. Функции состояния и функции процесса. Формулировки первого закона термодинамики. Математическое выражение первого закона. Термохимия. Тепловые эффекты в процессах, протекающих при постоянном давлении и постоянном объеме. Теплоемкость, теплоемкости при постоянном давлении и постоянном объеме, связь между ними, уравнение Майера. Температурная зависимость теплоемкости. Расчет работы и теплоты в простейших термодинамических процессах.
Внутренняя энергия U – этообщий запас энергии системы, который складывается из энергии движения и взаимодействия молекул, ядер и электронов в атомах, т. е. всех видов энергии системы кроме кинетической энергии системы как целого и её потенциальной энергии положения. Абсолютную величину U определить невозможно, можно определить только её изменение ∆U. Внутренняя энергия зависит от природы вещества, Т, р, агрегатного состояния и др. U – это функция состояния системы.
Другая функция состояния системы - это энтальпия Н. H=U + pV ,где p∆V – работа расширения. Энтальпию называют энергией расширенной системы или теплосодержанием системы. Абсолютное значение H определить невозможно.
Для описания процессов протекающих при V = const используется ∆U. Для описания процессов протекающих при P = const используется ∆H. Разница между ∆U и ∆H значительна для систем, содержащих вещества в газообразном состоянии. Для конденсированных, особенно кристаллических состояний, разница между ∆U и ∆H относительно невелика.
Теплота и работа – это формы передачи энергии, величины которых характеризуют процесс и зависят от пути процесса; они функции процесса.
Теплота Q – это неупорядоченная форма передачи энергии. Она всегда связана с тепловым (хаотическим) движением частиц. Теплота внутри системы считается положительной, Q > 0, если тепло поглощается системой (эндотермический процесс). Теплота внутри системы отрицательна, Q < 0, если тепло выделяется системой (экзотермический процесс).
Тепловой эффект 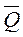 – это изменение теплоты в окружающей систему среде (теплота, которая выделяется в окружающую среду их системы или поглощается из окружающей среды системой) в результате процесса. При этом
– это изменение теплоты в окружающей систему среде (теплота, которая выделяется в окружающую среду их системы или поглощается из окружающей среды системой) в результате процесса. При этом
∆Q > 0 →  <0 (эндотермический процесс),
<0 (эндотермический процесс),
∆Q < 0 → 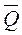 > 0 (экзотермический процесс).
> 0 (экзотермический процесс).
То есть  , теплота и тепловой эффект отличаются по знаку.
, теплота и тепловой эффект отличаются по знаку.
Работа А – это упорядоченная форма передачи энергии. Работа считается положительной A > 0, если она совершается системой против внешних сил (например, расширение газа), и работа отрицательна A < 0, если она производится внешними силами над системой (например, сжатие газа). Работа представляет сумму 
здесь 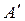 - это полезная работа (работа против гравитационных, электрических и других сил, несвязанных с изменением термодинамических параметров);
- это полезная работа (работа против гравитационных, электрических и других сил, несвязанных с изменением термодинамических параметров);  - работа по преодолению внешнего давления, необходимая для удержания системы в состоянии механического равновесия или работа расширения. Для многих систем она единственный вид работы, поэтому
- работа по преодолению внешнего давления, необходимая для удержания системы в состоянии механического равновесия или работа расширения. Для многих систем она единственный вид работы, поэтому 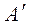 = 0 и A = p∆V.
= 0 и A = p∆V.
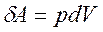 , тогда
, тогда 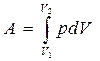 ,
,
здесь d – мгновенное изменение; δ – бесконечно малая величина; индекс 1 – начальное, а индекс 2 – конечное состояние системы.
Первый закон термодинамики – это постулат. Известны следующие формулировки закона.
1. Закон сохранения энергии, в применении его к термодинамическим процессам, является одним из выражений первого закона термодинамики: в изолированной системе общий запас энергии сохраняется постоянным.
2. Энергия переходит из одного вида (формы) в другой в строго эквивалентных количествах.
3. Вечный двигатель первого рода невозможен: получить работу не затрачивая энергию нельзя.
Пусть система переходит из состояния 1 в состояние 2. При этом система поглощает теплоту Q, которая расходуется на изменение внутренней энергии системы ∆U и совершение работы А.
 Q = ∆U + A или
Q = ∆U + A или 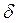 Q = dU +
Q = dU + 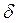 A. (1.1)
A. (1.1)
Это математическое выражение первого закона термодинамики.
Рассмотрим изохорный процесс (V = const): 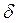
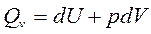 .
.
Если V = const, то dV = 0, тогда pdV = 0 и, следовательно,
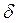
 или
или 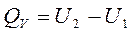 . (1.2)
. (1.2)
Тепловой эффект реакции при изохорном процессе равен изменению внутренней энергии системы.
Рассмотрим изобарный процесс (р = const):
 или
или 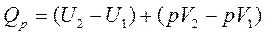 ,
,
или 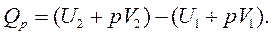
Так как 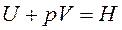 - это энтальпия системы, тогда
- это энтальпия системы, тогда
 или
или  и
и
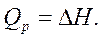 (1.3)
(1.3)
В изобарном процессе тепловой эффект реакции равен изменению энтальпии.
Заменим выражение 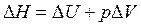 на выражение
на выражение 
Согласно уравнению Клайперона-Менделева 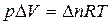 , тогда
, тогда
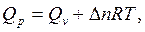 (1.4)
(1.4)
где 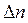 - изменение числа молей газообразных веществ, участвующих в реакции.
- изменение числа молей газообразных веществ, участвующих в реакции.
Для конденсированных систем Qр = QV.
Теплоёмкость –это количество тепла, необходимое для нагревания данного количества вещества на один градус. Удельная и молярная теплоёмкость– это отношение количества теплоты Q, поглощённое одним граммом (Суд - удельная) или одним моль (См - молярная) вещества к повышению температуры (∆T = T2 – T1), которым сопровождается его нагревание.
Единицы измерения теплоемкости: [Cуд] = Дж/г·К, [Cм] = Дж/моль·К.
Средняя теплоемкость  определяется как
определяется как
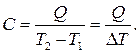 (1.5)
(1.5)
Истинная теплоемкость определяется как
 (1.6)
(1.6)
При p = cons: 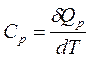 ; при V = const:
; при V = const: 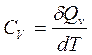 . (1.7, 1.8)
. (1.7, 1.8)
Разница между теплоемкостью при изобарных и теплоемкостью при изохорных условиях равна газовой постоянной R и описывается уравнением Майера: Cр – CV = R.
Теплоемкость зависит от температуры. Зависимость C = f(T) выражается эмпирическими уравнениями, найденными опытным путём. Они имеют вид:
 или
или 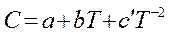 , (1.9, 1.10)
, (1.9, 1.10)
где 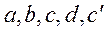 - коэффициенты, получаемые после обработки экспериментальных данных; они приведены в справочниках.
- коэффициенты, получаемые после обработки экспериментальных данных; они приведены в справочниках.
Применение первого закона термодинамики рассмотрим на примерах расчетов работы и теплоты в термодинамических процессах. Выражения зависимости работы и теплоты от параметров р, V, T системы в конечном (индекс 2) и начальном (индекс 1) состояниях системы в четырех основных процессах с идеальным газом приведены в табл. 1.
Таблица 1