Термодинамические потенциалы.
Энтропия. Общая формулировка второго закона (начала) термодинамики.
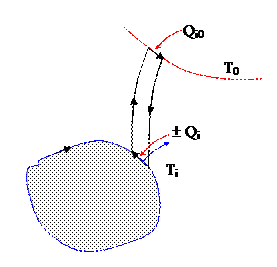 Можно показать, что для замкнутого равновесного цикла справедливо следующее интегральное соотношение
Можно показать, что для замкнутого равновесного цикла справедливо следующее интегральное соотношение
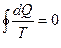 (2)
(2)
(dQ – дифференциальная теплота обмена с источником при температуре T). Доказательство проводится по схеме, представленной на рисунке. Основной цикл совмещают с дифференциальными циклами Карно между базовой температурой T0 и температурой Ti участка цикла. При этом теплоты принятые и отданные на участке основного цикла делают равными. Известно, что для цикла Карно
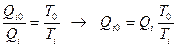 .
.
В результате такого «сложного» цикла система получает тепло 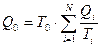 и полностью превращает его в работу, что запрещено постулатом Клаузиуса (вторым началом термодинамики). Поэтому должно выполняться условие (2), определенное выше. Формула (2) позволяет ввести в термодинамику понятие энтропии, как функции состояния системы.
и полностью превращает его в работу, что запрещено постулатом Клаузиуса (вторым началом термодинамики). Поэтому должно выполняться условие (2), определенное выше. Формула (2) позволяет ввести в термодинамику понятие энтропии, как функции состояния системы.

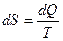 (3)
(3)
При дифференциальном (равновесном) обмене теплотой с источником изменение энтропии системы равно  . Для двух произвольных состояний системы изменение энтропии в ходе равновесного перехода записывается интегралом
. Для двух произвольных состояний системы изменение энтропии в ходе равновесного перехода записывается интегралом
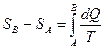 . (4)
. (4)
Если процесс перехода в новое состояние не является равновесным, то соотношение (4) должно записываться в виде неравенства
 . (5)
. (5)
Для теплоизолированной системы получаем
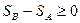 . (6)
. (6)
Изменение энтропии замкнутой системы возможно только при условии, что система находилась в неравновесном состоянии. Потому, энтропия изолированной неравновесной системы при переходе к равновесию увеличивается.
Соотношение (6) является наиболее общей формой второго начала термодинамики и называется неравенством Клаузиуса.
Использование формулы (3) позволяет записывать первый закон термодинамики для равновесных процессов с использованием дифференциала энтропии (для газа)[10]
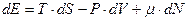 . (7)
. (7)
6. Третье начало термодинамики. (сформулировано В.Г. Нернстом в 1906 году) При приближении температуры к 0 К энтропия стремится к определенному пределу. Равновесные процессы при 0 К проходят без изменения энтропии. Энтропия при 0 К не зависит от значений параметров, характеризующих состояние системы (объема, давления и т.д.). Числовое значение энтропии при 0 К не фиксировано, но его удобно выбрать равным нулю.[11]
Третье начало термодинамики. (сформулировано В.Г. Нернстом в 1906 году) При приближении температуры к 0 К энтропия стремится к определенному пределу. Равновесные процессы при 0 К проходят без изменения энтропии. Энтропия при 0 К не зависит от значений параметров, характеризующих состояние системы (объема, давления и т.д.). Числовое значение энтропии при 0 К не фиксировано, но его удобно выбрать равным нулю.[11]
В термодинамике чаще всего используют четыре энергетические функции, называемые термодинамическими потенциалами: энергия, свободная энергия Гельмгольца, термодинамический потенциал Гиббса (большой потенциал), энтальпия (тепловая функция).
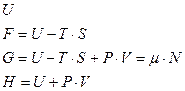 . (8)
. (8)
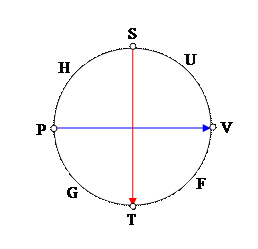
Дифференциалы этих потенциалов можно получить, используя мнемоническую схему Максвелла.
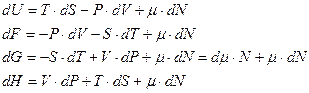 . (9)
. (9)
Символ термодинамического потенциала стоит между двумя величинами, которые «образуют» дифференциалы. Множители дифференциалов стоят напротив величин. Знак слагаемого определяется направлением стрелок. «Движение» от дифференциала к множителю против стрелки дает знак минус (по стрелке плюс). Треть слагаемое у всех дифференциалов одинаковое. Формулы (9) уточняют определение химического потенциала. Наиболее «понятное» определение получается на основе термодинамического потенциала Гиббса.

m - численно равно удельному изменению потенциала Гиббса при условиях постоянства температуры и давления.
Смысл введения термодинамических потенциалов состоит в следующем. При различных условиях равновесие системы соответствует минимуму некоторого термодинамического потенциала.