Физическая и химическая адсорбция
Как отмечалось ранее, нескомпенсированность межмолекулярных сил на межфазной поверхности приводит к образованию вблизи поверхности силового поля. В результате в поверхностном слое должны концентрироваться компоненты, понижающие энергию системы в целом. Это явление самопроизвольного повышения (изменения) концентрации компонента в поверхностном слое по сравнению с объемной фазой, называют адсорбцией. Движущей силой процесса адсорбции является стремление системы к уменьшению поверхностного натяжения. Различают адсорбцию газа на твердом теле, адсорбцию растворенного вещества на границе раствор - газ и на границе твердое тело - раствор. Следует отметить, что следствием существования избыточной энергии поверхности является не только адсорбция, но также смачивание поверхности, растекание жидкости на поверхности, капиллярные явления.
Вещество, на поверхности которого происходит адсорбция, называют адсорбентом, которое может поглощаться из объемной фазы -адсорбтивом, а уже поглощенное - адсорбатом. Количественной мерой адсорбции i-го компонента по Гиббсу, служит величина  определяемая как избыток (в молях) компонента, приходящийся на единицу площади поверхности раздела фаз, чаще как моль/м2. На практике площадь поверхности не всегда известна и данные по адсорбции выражают через количество газа, адсорбированного единицей массы адсорбента, например, моль/г. Из этого следует, что адсорбция растет с увеличением дисперсности твердой фазы адсорбента, поэтому важнейшим параметром является удельная поверхность, т.е. площадь, приходящаяся на единицу массы, доступная адсорбтиву.
определяемая как избыток (в молях) компонента, приходящийся на единицу площади поверхности раздела фаз, чаще как моль/м2. На практике площадь поверхности не всегда известна и данные по адсорбции выражают через количество газа, адсорбированного единицей массы адсорбента, например, моль/г. Из этого следует, что адсорбция растет с увеличением дисперсности твердой фазы адсорбента, поэтому важнейшим параметром является удельная поверхность, т.е. площадь, приходящаяся на единицу массы, доступная адсорбтиву.
Процесс, обратный адсорбции, называют десорбцией. Если газ проникает в объем адсорбента, то процесс называют абсорбцией, а если механизм неизвестен, то применяют общий термин - сорбция.
В зависимости от характера силовых взаимодействий между молекулами адсорбата и поверхностью адсорбента различают физическую адсорбцию (физадсорбцию) и химическую адсорбцию (хемосорбцию). Часто они составляют два последовательных этапа единого сорбционного процесса. Физическая адсорбция и хемосорбция термодинамически неразличимы, но характеризуются различными значениями дифференциальной молярной теплоты адсорбции.
Физическая адсорбция обусловлена неспецифическими (универсальными) силами межмолекулярного взаимодействия, в основном силами Ван-дер-Ваальса. Отличительная черта физической адсорбции -обратимость, которая обусловлена низкими величинами теплот адсорбции (4 - 40 кДж/моль или 1 - 10 ккал/моль). По своей природе эти взаимодействия относятся к типу электростатических диполь-дипольных взаимодействий и включают:
а) дисперсионные силы, порожденные синхронными осцилляциями взаимодействующих диполей, - характерны для адсорбции неполярных молекул (N2, О2, Н2 и инертных газов) на неполярных адсорбентах (типа графита и угля);
б) индукционные силы, порожденные взаимодействием диполя с другим наведенным им диполем, - характерны для адсорбции неполярных молекул (N2, О2,. Н2 и инертных газов) на полярных адсорбентах с ионной связью (типа SiO2 , Al2О3 и др.) и для адсорбции полярных молекул (Н2O, СО2, NH3 и др.) на неполярных адсорбентах и металлах;
в) ориентационные силы, порожденные взаимной ориентацией взаимодействующих диполей, - характерны для адсорбции полярных молекул (Н2О, СО2, NH3 и др.) на полярных адсорбентах с ионной связью (типа SiO2 , и др.).
Кроме диполь-дипольных, в физической адсорбции участвуют ион-дипольные и квадрупольные взаимодействия.
Хемосорбция, наоборот, - необратима и характеризуется высокими тепловыми эффектами (40 - 400 кДж/моль или 10 - 100 ккал/моль), обусловленными образованием поверхностных химических соединений с валентной связью. Хемосорбцию иногда представляют как двумерную химическую реакцию, не выходящую за пределы поверхностного слоя. Например, в результате хемосорбции кислорода на поверхности железа или алюминия образуется пленка продуктов взаимодействия - оксидов, которая защищает металл от дальнейшего окисления.
Между физической и химической адсорбцией существуют промежуточные случаи, например, адсорбция, обусловленная образованием водородной связи. Водородная связь, в отличие от сил Ван-дер-Ваальса, является специфической, т.е. локальной, поскольку обусловлена невалентным взаимодействием атома водорода протонодонорной группы (OH, NH2, COOH) с электроотрицательными атомами O, N, F, S, Cl, имеющими неподеленную электронную пару (акцепторы протонов). Водородная связь обеспечивает адсорбцию полярных молекул (Н2О, CO2, NH3 и др.) на поверхности адсорбентов с гидроксильными группами ОН или кислородом (типа стекол, силикагелей и цеолитов). Распределение электронной плотности в гидроксильных группах, прочно связанных с атомами кремний-кислородного остова, таково, что отрицательный заряд в них смещен к атому кислорода. Следовательно, гидроксильная группа ОН представляет собой электрический диполь с положительным зарядом у атома водорода, выдвинутым наружу.
Этот положительный заряд и обеспечивает связь с отрицательными зарядами других молекул, например, молекул воды. Именно этим обусловлены высокие сорбционные свойства по отношению к Н2О у стекол, силикагелей (гелей кремниевой кислоты H2SiO3) и цеолитов (кристаллических алюмосиликатов щелочных и щелочноземельных металлов).
При физической адсорбции адсорбированная молекула сохраняет свою структуру, не теряя индивидуальности, т. е. молекула и адсорбент представляют собой независимые подсистемы, связанные слабыми силами Ван-дер-Ваальса. Так как прочность межмолекулярных связей невелика, то физически адсорбированная молекула может быть относительно легко удалена с поверхности.

|
| Рис.3 Энергетическая диаграмма для процесса физической адсорбции на поверхности твердого тела |
Энергетическое состояние адсорбированной частицы принято изображать в виде диаграммы U(x), показывающей зависимость энергии взаимодействия частицы с поверхностью твердого тела от расстояния до этой поверхности. На энергетической диаграмме устойчивому состоянию физической адсорбции соответствует положение молекулы в потенциальной яме глубиной Uф, расположенной на расстоянии хф от поверхности. Величина Uф определяется силой взаимодействия молекулы с поверхностью и называется энергией физической адсорбции. Данный процесс всегда идет с выделением энергии в виде теплоты физической адсорбции  :
:
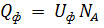
где NA - число Авогадро.
Адсорбированная молекула, удерживаемая силами Ван-дер-Ваальса в потенциальной яме, совершает тепловые колебания по нормали к поверхности. Тепловые колебания в направлении нормали к поверхности, совершаемые молекулами в потенциальной яме, приводят к тому, что наиболее энергичные из них покидают поверхность. Среднее время τa жизни молекулы в адсорбированном состоянии зависит от энергии физической адсорбции  . Оно определяется соотношением, полученным для диффузионных скачков частицы в периодическом поле кристаллической решетки:
. Оно определяется соотношением, полученным для диффузионных скачков частицы в периодическом поле кристаллической решетки:
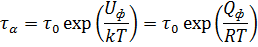
Здесь  по порядку величины близка к периоду колебаний молекулы в потенциальной яме, определяемому упругостью ее связи с поверхностью. Так как для разных адсорбционных пар упругость связи примерно одинакова, то полагают
по порядку величины близка к периоду колебаний молекулы в потенциальной яме, определяемому упругостью ее связи с поверхностью. Так как для разных адсорбционных пар упругость связи примерно одинакова, то полагают  ~ 10-13 сек. Теплота физической адсорбции
~ 10-13 сек. Теплота физической адсорбции  обычно не превышает 10 ккал/моль, тогда величина
обычно не превышает 10 ккал/моль, тогда величина 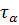 , вычисленная по формуле, при комнатной температуре измеряется микросекундами, уменьшаясь с ростом температуры.
, вычисленная по формуле, при комнатной температуре измеряется микросекундами, уменьшаясь с ростом температуры.
Время жизни адсорбированной молекулы является одним из основных параметров, определяющих постоянную времени процесса физической адсорбции. Количественной характеристикой процесса служит степень заполнения адсорбционных центров, определяемая как θ(t) = Na (t)/ Nц, где Na (t) - концентрация занятых адсорбционных центров (т. е. адсорбированных молекул) в момент времени t, a Nц- общее число адсорбционных центров на единице площади. Адсорбция происходит не на всей поверхности твердого тела, а только на активных центрах.
Физической адсорбцией начинается и заканчивается сорбционный процесс только для инертных газов, молекулы которых, имея завершенную электронную конфигурацию, способны удерживаться у поверхности лишь межмолекулярными силами Ван-дер-Ваальса. Молекулы других газов и паров металлов, пройдя этап физической адсорбции, способны к дальнейшему более сильному взаимодействию с поверхностью за счет сил химической природы типа гомеополярной и гетерополярной связи. Поскольку такая связь возможна лишь на атомарном уровне, то физически адсорбированная молекула предварительно диссоциирует на атомы, которые и обеспечивают межатомное взаимодействие, лежащее в основе процесса хемосорбции.
Энергетическая диаграмма для сорбционного процесса, включающего физическую адсорбцию и хемосорбцию как последовательные этапы, изображена на рисунке 4. Пунктирная кривая 1 описывает процесс физической адсорбции, а кривая 2 - процесс химической адсорбции двух атомов, возникающих в результате диссоциации исходной молекулы.

|
| Рис. 4. Энергетическая диаграмма для последовательных этапов физической и химической адсорбции двухатомной молекулы на поверхности твердого тела |
Сплошная кривая 3 описывает результирующий процесс адсорбции молекулы следующим образом. Приближающаяся к поверхности молекула самопроизвольно физически адсорбируется, т. е. скатывается в потенциальную яму I глубиной Uф и располагается на расстоянии хф от поверхности. Дальнейший переход такой молекулы в хемосорбционную потенциальную яму II глубиной Ux в виде двух атомов, расположенных на расстоянии хх, требует преодоления потенциального барьера высотой Ех, который разделяет ямы I и II. На это способны лишь молекулы, обладающие достаточным запасом энергии, превышающим энергию диссоциации Едис. Высота Ех хемосорбционного потенциального барьера называется энергией активации процесса хемосорбции. В этом смысле хемосорбция, подобно диффузии, является термоактивационным процессом. Поэтому ее часто называют активированной адсорбцией.
Поскольку межатомные силы в 5-10 раз превышают силы Ван-дер-Ваальса, то теплота химической адсорбции Qx = UxNA достигает 40-100 ккал/моль. Это обеспечивает времена жизни частицы в адсорбированном состоянии, измеряемые часами, сутками и даже годами в зависимости от температуры.
Энергетическая диаграмма позволяет дать, подтвержденное экспериментом, объяснение температурного хода стационарной степени заполнения адсорбционных центров θ0, качественно показанного на рис. 5, которое приведено ниже.

|
| Рис. 5. Температурная зависимость стационарной степени заполнения адсорбционных центров |
В области низких температур энергия тепловых колебаний физически адсорбированных молекул недостаточна для их отрыва от поверхности. В результате возникает адсорбционный монослой со степенью заполнения θ0, близкой к единице. С повышением температуры величина θ0 падает из-за увеличения вероятности выброса молекул наружу из потенциальной ямы I (см. рис. 4). По мере роста температуры вступает в действие конкурирующий процесс переброса молекулы (в форме двух атомов) через активационный барьер Ех в яму II. Следовательно, при достаточно большой температуре процесс превращения физически адсорбированных молекул в хемосорбированные атомы начинает преобладать над процессом теплового выброса первых наружу из потенциальной ямы I. Это объясняет рост, начинающийся с некоторой температуры Т0 на рис. 5. Однако при еще более высокой температуре хемосорбированные атомы имеют настолько высокую энергию тепловых колебаний, что выбрасываются наружу из потенциальной ямы II глубиной (Ux+Ex) и, соединившись в молекулы, испаряются с поверхности. В результате этого появляется хемосорбционный максимум на кривой (рис 4.). Термоактивационная природа делает процесс хемосорбции, в отличие от физической адсорбции, необратимым: изменение температуры от Т1 до Т2 с последующим возвратом к исходной температуре Т1 не оставляет неизменным количество адсорбированного газа.