Первое начало термодинамики
Внутренняя энергия системы может быть изменена только в результате взаимодействия системы с внешней средой. Такое взаимодействие может происходить двумя способами: путём теплообмена и путём совершения механической работы.
Теплообмен - самопроизвольный необратимый процесс передачи энергии, происходящий в неоднородном темпера- турном поле.
Существуют следующие способы теплообмена:
а) теплопроводность - передача внутренней энергии от одних тел к другим при их соприкосновении, обусловленная тепловым движением атомов (молекул);
б) конвекция - перенос энергии, происходящий при перемешивании неодинаково нагретых слоев газа или жидкости под действием силы тяжести и выталкивающей силы;
в) излучение - передача внутренней энергии без участия промежуточной среды путём испускания и поглощения электро- магнитного излучения.
Мерой энергии, передаваемой системе при теплообмене, служит количество теплоты Q. Элементарное приращение количества теплоты dQ > 0, если оно передаётся системе, и dQ < 0, если система отдаёт энергию. Отношение элементарного количества теплоты dQ, сообщаемого системе при бесконечно малом изменении её состояния в каком-либо процессе, к соответствующему изменению dT её абсолютной температуры, называется теплоёмкостью системы:

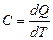 ; . .
; . .
Таким образом, теплоёмкость системы численно равна количеству теплоты, которое необходимо сообщить системе, для её нагревания на 1 К. Удельная теплоёмкость- физическая величина, равная количеству теплоты, которое необходимо сообщить 1 кг вещества для нагревания на 1 К:
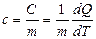 |  |
; .
 Молярная теплоёмкость - теплоёмкость одного моля вещества:
Молярная теплоёмкость - теплоёмкость одного моля вещества:
.
Следует различать теплоёмкости cр , СР и cv, CV. Первые характеризуют теплообмен при постоянном давлении, а вторые - при постоянном объёме.
Так как количество теплоты Q не является парамет- ром состояния термодинамической системы, то элементарное количество теплоты является не полным дифференциалом, поэтому его обозначают 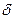 Q (сравните: внутренняя энергия системы - функция состояния; малое изменение внутренней энергии - полный дифференциал dU).
Q (сравните: внутренняя энергия системы - функция состояния; малое изменение внутренней энергии - полный дифференциал dU).
Но состояние системы можно изменить и другим способом, совершая над системой работу или давая ей возможность самой совершать работу, то есть путём изменения макроскопических параметров системы.
В качестве системы рассмотрим идеальный газ в сосуде с подвижным поршнем (рис 3.1). Если под действием силы 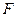 , с которой газ действует на поршень, последний переместился на расстояние dx, то газ совершил работу
, с которой газ действует на поршень, последний переместился на расстояние dx, то газ совершил работу

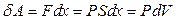 ,
,
где P - давление газа, S - площадь поршня, dV = S dx приращение объёма газа.
Элементарная работа  - не полный дифференциал, так как работа зависит не только от начального и конечного состояния системы, но и от формы пути, по которому система переходит из одного состояния в другое, а значит А не является функцией состояния. Если газ расширяется, то dV>0 и, совершаемая им работа
- не полный дифференциал, так как работа зависит не только от начального и конечного состояния системы, но и от формы пути, по которому система переходит из одного состояния в другое, а значит А не является функцией состояния. Если газ расширяется, то dV>0 и, совершаемая им работа 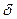 А > 0, если сжимается - газ совершает отрицатель- ную работу,
А > 0, если сжимается - газ совершает отрицатель- ную работу, 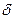 А < 0.
А < 0.
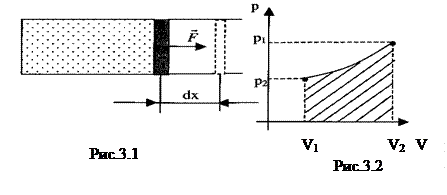 |
При расширении (сжатии) газа может изменяться не только объём, но и его давление. Поэтому, чтобы найти работу при конечном изменении объёма, нужно знать зависимость р(V). Тогда работа определяется интегралом
 , (3.6)
, (3.6)
который численно равен площади заштрихованной фигуры (рис.3.2).
Закон сохранения энергии в области тепловых явлений называется первым началом термодинамики: теплота, сообщаемая системе, затрачивается на увеличение внутрен- ней энергии системы и на работу, которую система совершает над внешней средой
 . (3.7)
. (3.7)