Два металла, погруженные в растворы их солей, соединенные между собой электролитическим ключом, образуют гальванический элемент.
Возникновение электрического тока в гальваническом элементе обусловлено разностью электродных потенциалов взятых металлов и сопровождается глубокими химическими превращениями, протекающими на электродах. Рассмотрим медно-цинковый гальванический элемент.
На цинковом электроде, опущенном в раствор ZnSO4, происходит окисление атомов в ионы (растворение цинка)
Zn-2e = Zn2+- (7.2.1)
Электроны поступают во внешнюю цепь. Цинк - источник электронов. На электроде из меди, погруженном в раствор CuSO4, происходит восстановление ионов металла в атомы (осаждаются на электроде)
Cu2+ + 2e = Cu. - (7.2.2)"
Одновременно часть ионов SO42- переходит через пористую перегородку в сосуд с раствором ZnSO4.
Суммарное уравнение процесса получим, сложив уравнения (7.2.1) и (7.2.2),
Zn - 2е = Zn2+ (анодный процесс)
Сu2++ 2е = Сu (катодный процесс)
или в молекулярной форме
Zn + CuSO4 = ZnSO4 + Сu.
Это - обычная реакция окисления - восстановления. Электрическая энергия такого гальванического элемента получается за счет химической энергии реакции.
Цинковый электрод - источник электронов, поступающих во внешнюю цепь, - принято считать отрицательным, а медный электрод - положительным. Названия электродам дается в соответствии с процессами, которые на них протекают: электрод, на котором протекает процесс окисления, называется анодом,а электрод, на котором протекает процесс восстановления - катодом.В рассматриваемом элементе цинк - анод (А), медь - катод (К). Гальванический элемент можно записать в виде краткой электрохимической схемы, например
A(-)Zn|Zn2+||Cu2+|Cu(+)K,
где одна черта означает границу между электродом и раствором, две
черты - границу между растворами, в скобках знаки ионов, причем анод
записывается слева, катод - справа. -
Необходимое условие работы гальванического элемента - разность потенциалов его электродов, она называется электродвижущей силой гальванического элемента- ЭДС.
ЭДС всякого работающего элемента - величина положительная. ЭДС любого биметаллического элемента можно вычислить по разности электродных потенциалов. Для этого надо из величины более положительного потенциала вычесть величину менее положительного. Так, ЭДС медно-цинкового элемента равна разности между потенциалами меди (катода) и цинка (анода), то есть
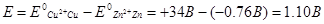
Пример: разобрать работу железо-медного гальванического элемента, если известно, что E°Fe = -0,44В и Е0Сu = 0,337В
Решение: ионы железа имеют в растворе заряд Fe2+, а ионы меди Си2+.
Поэтому железо-медный электрод имеет схему ,
Fe° | Fe2+|| Cu2+| Cu°.
Сравнивая электродные потенциалы, имеем
E°Fe = -0,44В <Е°Cu = +0,337В,
то есть железо - анод, медь - катод.
Тогда
ЭДС=ΔЕ = Е°Cu - E°Fe =+0.337B - (-0,44В) = 0,777 В.
Анодный процесс: Fe° - 2е = Fe2+,
Катодный процесс: Си2+ + е = Си0.
В процессе работы данного гальванического элемента происходит разрушение анода, то есть в данном случае разрушается железный электрод.
ТЕМА 7.3 ПОНЯТИЕ ЭЛЕКТРОЛИЗА