Свойства растворов
Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы С6Н12О6.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры, кипения раствора (Dt) no сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением:
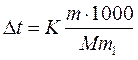 , (1)
, (1)
где К – криоскопическая или эбуллиоскопическая константа. Для воды они соответственно равны 1,86 и 0,52°; m и М – соответственно масса растворенного вещества и его мольная масса; m1 – масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим из формулы (1):
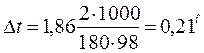 .
.
Вода кристаллизуется при 0°С, следовательно, температуры кристаллизации раствора 0 – 0,21 = -0,21°С.
Из формулы (1) находим и повышение температуры кипения 2%-ного раствора:
 .
.
Вода кипит при 100°С, следовательно, температура кипения этого растворе
100 + 0,06 = 100,06°С.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты C6H5COOH в 100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуглерода 46,3°С, Вычислите эбуллиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения Dt = 46,529 – 46,3 = 0,229°. Мольная масса бензойной кислоты 122 г/моль. Из формулы (1) находим эбуллиоскопическую константу:
 .
.
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислить мольную массу глицерина.
Решение. Температура кристаллизации чистой воды 0°С, следовательно, понижение температуры кристаллизации Dt = 0 – (-0,279) = 0,279°. Масса глицерина т(г), приходящаяся на 1000 г воды,
 .
.
Подставляя в уравнение
 (2)
(2)
данные, вычисляем мольную массу глицерина:
 .
.
Пример 4. Вычислите процентную концентрацию водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна -0,465°С.
Решение. Температура кристаллизации чистой воды 0°С, следовательно, Dt = 0 – (-0,465) = 0,465°. Мольная масса мочевины 60 г/моль. Находим массу m(г) растворенного вещества, приходящуюся на 100 г воды, из формулы (2):
 .
.
Общая масса раствора, содержащего 15 г мочевины, составляет 1000 + 15 = 1015 г. Процентное содержание мочевины в данном растворе находим из соотношения:
в 1015 г раствора – 15 г вещества.
" 100" " - х" " х = 1,48%.
Контрольные вопросы
161.Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296°С. Температура кристаллизации бензола 5,5°С. Криоскопическая константа 5,1°. Вычислите мольную массу растворенного вещества. Ответ: 128 г/моль.
162.Вычислите процентную концентрацию водного раствора сахара С12Н22О11, зная, что температура кристаллизации раствора -0,93°С. Криоскопическая константа воды 1,86°. Ответ: 14,6%.
163. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86°. Ответ: -1,03° С.
164. Раствор, содержащий 3,04 г камфоры C10H16O в 100 г бензола, кипит при 80,714°С. Температура кипения бензола 80,2°С. Вычислите эбуллиоскопическую константу бензола. Ответ: 2,57°.
165. Вычислите процентную концентрацию водного раствора глицерина C3H5(ОН)3, зная, что этот раствор кипит при 100,39°С. Эбуллиоскопическая константа воды 0,52°. Ответ: 6,45%.
166. Вычислите мольную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,279°С. Криоскопическая константа воды 1,86°. Ответ: 60 г/моль.
167.Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,2°С. Эбуллиоскопическая константа его 2,57°. Ответ: 81,25°С.
168.Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при –0,465° С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 342 г/моль.
169.Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718°С. Температура кристаллизации уксусной кислоты 16,65°С. Ответ: 3,9°.
170.При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81°. Сколько атомов содержит молекула серы в этом растворе. Эбуллиоскопическая константа бензола 2,57°. Ответ: 8.
171.Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна –0,558°С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 442 г/моль.
172.Какую массу анилина C6H5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53°. Эбуллиоскопическая константа этилового эфира 2,12°. Ответ: 1,16 г.
173.Вычислите температуру кристаллизации 2%-ного раствора этилового спирта C2H5OH. Криоскопическая константа воды 1,86°. Ответ: –0,82°С.
174.Сколько граммов мочевины (NN2)2СО следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465°? Криоскопическая константа воды 1,86°. Ответ: 1,12 г.
175.Вычислите процентную концентрацию водного раствора глюкозы C6H12O6, зная, что этот раствор кипит при 100,26°С. Эбуллиоскопическая константа воды 0,52°. Ответ: 8,25%.
176.Сколько граммов фенола C6H5OH следует растворить в 125 г бензола; чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7°? Криоскопическая константа бензола 5,1°. Ответ: 3,91 г.
177. Сколько граммов мочевины (NН2)2СО следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26°? Эбуллиоскопическая константа воды 0,52°. Ответ: 7,5 г.
178.При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372°. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 92 г/моль.
179.Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбуллиоскопическая константа воды 0,52°.Ответ: 101,52°С.
180.Вычислите процентную концентрацию водного раствора метанола СН3ОН, температура кристаллизации которого –2,79°С. Криоскопическая константа воды 1,86°. Ответ: 4,58%.