Химические источники электрической энергии. Электродные потенциалы
Электрохимическую реакцию окисления-восстановления можно провести так, что электроны будут переходить от восстановителя к окислителю в виде электрического тока, т.е. будет происходить превращение химической энергии в электрическую и для этой цели служат химические источники электрической энергии. Они подразделяются на аккумуляторы, топливные и гальванические элементы. Последние допускают лишь однократное использование, поскольку один из электродов необратимо расходуется. Аккумуляторы можно использовать многократно, т.к. их работоспособность может быть восстановлена при пропускании тока в обратном направлении от внешнего источника. Топливные элементы способны непрерывно работать в течение длительного времени благодаря тому, что к электродам постоянно подводятся реагенты.
Электрод, от которого движутся электроны (восстановитель), называется анодом (–), а электрод, к которому переходят электроны (окислитель), называется катодом (+). В роли анодов и катодов обычно выступают металлические пластинки (цинковые, медные, алюминиевые, никелевые и т.д.). При этом процессе один электрод постепенно растворяется, а другой покрывается дополнительным слоем металла из раствора его соли, в который он погружен. За положительный электрод – катод – принимают тот, который образован более электроотрицательным элементом в данной паре электродов.
Степень электроотрицательности элементов пары оценивается по электродному потенциалу элемента, который является количественной характеристикой активности металла.
Рассмотрим металлический стержень, погруженный в воду (рис.). Поскольку совершенно нерастворимых веществ не существует, любой металл хотя бы в ничтожной степени растворяется в воде, что обусловлено возрастанием энтропии при растворении. При этом в раствор переходят положительно заряженные ионы металла. В металле же остаются избыточные свободные электроны, т.е. на границе раздела двух фаз возникает двойной электрический слой, в котором электрическое поле направлено так, что препятствует дальнейшему растворению металла в воде и ионы металла скапливаются в поверхностном слое раствора. Если металлический электрод погрузить в раствор его соли, то процессы, протекающие на границе металл-раствор будут аналогичные.

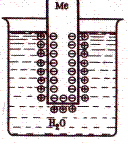
Величина скачка потенциала зависит от природы металла, концентрации ионов в растворе и температуры. Поэтому для сравнения электродных потенциалов выбраны стандартные условия: температура 25°С (298 К), давление 1,013∙105 Па, активность одноименного иона, равная единице (в 1 М растворе). Электродные потенциалы измеряют по отношению к водородному электроду, потенциал которого условно принимают равным нулю и называются стандартными электродными потенциалами (Е°, В). В зависимости от величины и знака стандартного электродного потенциала все металлы можно расположить в ряд стандартных электродных потенциалов, который фактически представляет собой ряд активности, эмпирически установленный Н.Н. Бекетовым по взаимному вытеснению металлов:
Cs, Li, Rb, K, Ba, Sr, Ca, Na, La, Mg, Be, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,