Идеальные и реальные растворы. Растворение как физико-химический процесс
Глава 7. ФИЗИКО-ХИМИЧЕСКАЯ ТЕОРИЯ РАСТВОРОВ ЭЛЕКТРОЛИТОВ И НЕЭЛЕКТРОЛИТОВ
Механизм образования растворов и их классификация
Растворами называются гомогенные системы, содержащие не менее двух веществ. Как правило, вещество взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке – растворенным веществом.
В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы.
Газообразными растворами являются воздух и другие смеси газов.
К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями.
Твердыми растворами являются многие сплавы, а также стекла.
Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространенным растворителем из неорганических веществ, конечно же, является вода. Из органических веществ в качестве растворителей используют метанол, этанол, диэтиловый эфир, ацетон, бензол, четыреххлористый углерод и др.
В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему. Способность к образованию растворов выражена у разных веществ в различной степени. Одни вещества способны смешиваться друг с другом в любых количествах (вода и спирт), другие – в ограниченных (хлорид натрия и вода).
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества – ненасыщенным.
Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества и раствор становится насыщенным. Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы – растворы с небольшим содержанием растворенного вещества; концентрированные растворы – растворы с большим содержанием растворенного вещества.
В зависимости от того, электронейтральными или заряженными частицами являются компоненты раствора, их подразделяют на молекулярные (растворы неэлектролитов) и ионные (растворы электролитов). Одна из характерных особенностей растворов электролитов заключается в том, что они проводят электрический ток.
Известны две основные теории растворов: физическая и химическая.
Физическая теория растворов предложена Вант-Гоффом и Аррениусом. Согласно этой теории, растворитель рассматривается как химически индифферентная среда, в которой равномерно распределены частицы (молекулы, ионы) растворенного вещества. При этом предполагается отсутствие межмолекулярного взаимодействия как между частицами растворенного вещества, так и между молекулами растворителя и частицами растворенного вещества. Частицы растворителя и растворенного вещества вследствие процессов диффузии перемешиваются и равномерно распределяются по всему объему раствора. Физическая теория удовлетворительно описывает поведение лишь малой группы растворов, так называемых идеальных растворов, в которых частицы растворителя и частицы растворенного вещества действительно практически не взаимодействуют между собой. Примерами идеальных растворов являются многие газовые растворы. Не реагирующие между собой газы смешиваются друг с другом в неограниченных соотношениях. Газовые смеси подчиняются газовым законам, как и индивидуальные газы. Физические свойства такой смеси (плотность, теплоемкость, давление и др.) вычисляются как аддитивные (сложение) из свойств компонентов, ее составляющих.
Например, по закону Дальтона общее давление газовой смеси равно сумме парциальных давлений ее компонентов:
Робщ = Р1 + Р2 + …+ Рn
где Робщ – общее давление газовой смеси; Р1, Р2, ... , Рn – парциальные давления компонентов 1, 2, ..., п. Парциальным давлением данного газа в смеси называют давление, которое производил бы газ, если бы он занимал объем смеси.
Химическая или сольватная теория растворов предложена Д.И. Менделеевым. Суть этой теории состоит в том, что между частицами растворенного вещества и молекулами растворителя происходит взаимодействие, в результате которого образуются нестойкие соединения переменного состава называемые сольватами или гидратами, если растворителем является вода. Главную роль в образовании сольватов играют непрочные межмолекулярные силы и, в частности, водородная связь.
Иногда гидратная вода настолько прочно связана с растворенным веществом, что при выделении его из раствора входит в состав его кристаллов. Кристаллические вещества, содержащие в своем составе воду, называются кристаллогидратами, а вода, входящая в структуру таких кристаллов, называется кристаллизационной. Так, кристаллогидрат сульфата меди (медный купорос) СuSO4·5H2O (синего цвета), СоСl2·6H2O (розово-красного цвета), СоСl2·4H2O (красного цвета), СоСl2·2H2O (сине-фиолетового), СоСl2·H2O (темно-синего).
Довольно часто растворяемое вещество может и химически взаимодействовать с растворителем, например хлор, растворяясь реагирует с водой (хлорная вода)
Сl2 + Н2О 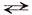 НСl + НОСl
НСl + НОСl
Аммиак, растворяясь в воде, одновременно образует гидрат аммиака:
NH3 + H2O 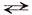 NH3·H2O
NH3·H2O 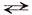 NH4+ + OH–
NH4+ + OH–
Как правило, при растворении поглощается или выделяется тепло и происходит изменение объема раствора. Объясняется это тем, что при растворении вещества происходят два процесса: разрушение структуры растворяемого вещества и взаимодействие частиц растворителя с частицами растворенного вещества. Оба эти процесса сопровождаются различными изменениями энергий. Так, при растворении серной кислоты в воде выделяется значительное количество теплоты, аналогичное явление наблюдается при растворении в воде безводного сульфата меди (экзотермические реакции). При растворении в воде нитрата калия или нитрата аммония температура раствора резко понижается (эндотермические процессы), а при растворении в воде хлорида натрия температура раствора практически не меняется.
Таким образом, растворы занимают промежуточное положение между химическими соединениями и смесями. С одной стороны растворы, как и химические соединения, однородны. Образование растворов сопровождается, как правило, тепловым эффектом, что свидетельствует о взаимодействии растворенного вещества с молекулами растворителя. С другой стороны, в растворах нет строгого стехиометрического соотношения между растворенным веществом и растворителем.