Ковалентная связь – связь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам.
Ковалентная связь
Химическая связь – взаимодействие атомов, обусловленное перекрытием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
Согласно теории химической связи, при образовании молекулы атомы стремятся приобрести устойчивую восьмиэлектронную (октет) или двухэлектронную (дублет) оболочки.
Образование устойчивой электронной конфигурации может происходить несколькими способами и приводить к молекулам (и веществам) различного строения, поэтому различают несколько типов химической связи – ионная, ковалентная, металлическая, водородная и ван-дер-ваальсова связи.
Важной характеристикой химической связи является длина связи, под которой понимают расстояние между центрами ядер атомов в молекуле или кристалле, когда силы притяжения уравновешены силами отталкивания и энергия системы минимальна. Длина связи в рядах однотипных соединений увеличиваются с возрастанием атомарного номера элемента.
Химическая связь характеризуется определенной пространственной направленностью. Если двухатомные молекулы всегда линейны, то формы многоатомных молекул различны.
Между взаимодействующими атомами, которые различаются по электроотрицательности, возникают полярные связи. В результате смещения электронной плотности в сторону более электроотрицательного атома происходит образование положительных и отрицательных зарядов, и возникает диполь, представляющий собой систему из двух равных и противоположных по знаку зарядов s+ и s–, находящихся на определенном расстоянии друг от друга.
Lis+®Fs– l = 0,21 нм
Диполь выражается через электрический момент диполя m, представляющий собой произведение заряда s на длину диполя l:
m = l ∙s
При наличии нескольких связей в молекуле, их электрические моменты складываются по правилу параллелограмма.
В 1916 г. Дж. Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам – эта идея послужила основой для разработки современной теории ковалентной связи. В том же году В. Коссель предположил, что химическая связь возникает при взаимодействии двух атомов, один из них отдает электроны, превращаясь в положительно заряженный ион (катион), а второй атом принимает электрон, превращаясь в отрицательно заряженный ион (анион). Дальнейшее развитие идей Косселя привело к созданию представлений об ионной связи.
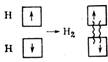
Н·+ ·Н® Н : Н или Н – Н
Ковалентная связь между одинаковыми атомами называется неполярной. Электрический момент диполя равен нулю.
Ковалентная связь возникающая при взаимодействии атомов разных элементов называется полярной, при этом общая электронная пара (или электронные пары) несколько смещаются в сторону более полярного атома.
Ковалентная связь самый распространенный тип химической связи. Теоретическое обоснование важнейших свойств ковалентной связи и развитие представлений о строении большинства молекул получено способом приближенного расчета систем из ядер и электронов, называемого метод валентных связей (МВС).
Главные положения МВС:
- ковалентную связь образуют два электрона с антиполярными спинами;
- ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Способы образования ковалентной связи:
- обменный способ – образование общей пары электронов, одновременно принадлежащая обоим атомам (H2, Cl2, HCl).
- донорно-акцепторный способ – образование связи в результате перехода уже существующей электронной пары донора (поставщика электронов) в общее пользование донора и другого атома – акцептора, предоставляющего для этой пары свободную орбиталь (NH4+, С≡O).
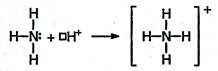
В качестве доноров обычно выступают атомы с большим количеством электронов, но имеющие небольшое число неспаренных электронов (так, у азота одна неподеленная пара, у кислорода две неподеленные пары, у фтора три неподеленные пары).
Свойства ковалентной связи:
Насыщаемость ковалентной связи – способность атомов участвовать в образовании ограниченного числа ковалентных связей.
Поляризация ковалентной связи – смещение связывающего электронного облака под влиянием одного из атомов, результатом чего является полярная связь.
Полярность связи количественно оценивается дипольным моментом μ, который является произведением длины диполя l на абсолютную величину заряда q: μ = lq.
Для оценки степени полярности связи часто используют электроотрицательность (ЭО) – способность атома притягивать к себе валентные электроны других атомов.
По шкале Полинга ЭО фтора (наиболее электроотрицательного из всех элементов) принята равной 4,0; на втором месте находится кислород, на третьем – хлор. Водород и типичные неметаллы находятся в центре шкалы; значения их ЭО близки к 2. Большинство металлов имеют значения ЭО, приблизительно равные 1,7 или меньше.
Связи с разностью ЭО больше 1,7 могут считаться ионными, связи с меньшей разностью относят к ковалентным.
Направленность ковалентной связи– главное свойство, от которого зависит структура химических соединений.
Нередко электроны, участвующие в образовании химической связи находятся в различных состояниях, например один на s-орбитали, другой на р-орбитали. Так, в BeCl2 две связи теоретически должны быть неравноценны, в то же время экспериментально показано, что обе связи эквивалентны (др. пример – СН4).
Для объяснения подобных фактов Полинг ввел представление о гибридизации электронных облаков – выравнивание электронных облаков по форме и энергии. При образовании молекулы вместо исходных s, p, d-электронных облаков образуются гибридные электронные облака (рис.).
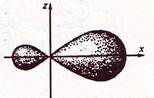 Рис. Форма sp-гибридной орбитали
Рис. Форма sp-гибридной орбитали
| 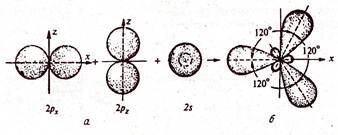 Рис. Схема образования sp3-гибридных орбиталей:
а – негибридизированные орбитали атома углерода.
б – орбитали атома углерода в состоянии sp3-гибридизации
Рис. Схема образования sp3-гибридных орбиталей:
а – негибридизированные орбитали атома углерода.
б – орбитали атома углерода в состоянии sp3-гибридизации
|
Если в гибридизации участвуют 1 s- и 2 p-орбитали, образуются три sp2-орбитали (sp2 – гибридизация). Если в гибридизации участвуют 1 s- и 1 p-орбитали, образуются 2 sp-орбитали (sp – гибридизация).
Геометрическая форма гибридных облаков способствует более эффективному перекрыванию с орбиталями других атомов, в результате чего образуются более прочные химические связи.
Рассмотрим образование молекулы метана СН4. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя р-электронами –2s12p3. Теоретически следовало ожидать, что три связи С–Н в СН4 окажутся направленными р-связями и совершенно одинаковыми, а четвертая связь есть ненаправленная s-связь и отличается от первых трех. Однако экспериментальные данные показали, что все четыре связи С–Н в молекуле метана СН4 одинаковы и направлены к вершинам тетраэдра (угол между ними составляет 109,5°).
Электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака. Это обусловливает более сильное перекрывание гибридных орбиталей с орбиталями электронов других атомов и приводит к образованию более прочных связей.
Гибридизация орбиталей происходит всегда, когда в образовании связей участвуют электроны, принадлежащие к различным типам орбиталей.
Рассмотрим примеры различных видов гибридизации s- и р-орбиталей. Гибридизация одной s- и одной р-орбиталей (sр-гибридизация) происходит при образовании молекул галогенидов элементов II группы (Ве, Mg, Zn и др.). Атомы этих элементов в основном состоянии имеют на внешнем слое два спаренных s-электрона. В результате возбуждения один из электронов s-орбитали переходит на близкую по энергии p-орбиталь. При возникновении химической связи эти две различные орбитали превращаются в две одинаковые гибридные орбитали (тип гибридизации - sр), направленные под углом 180° друг к другу, т.е. эти две связи имеют противоположное линейное направление.

В молекуле ацетилена С2Н2 каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С–С, так и в случае связей С–Н возникает общее двухэлектронное облако, образующее σ-связи.