Взаимодействие галогенов с водой.
Взаимодействие галогенов с водой - сложный процесс, включающий растворение, образование сольватов и диспропорционирование.
Фтор в отличие от других галогенов воду окисляет:
2H2O + 2F2 = 4HF + O2.
Однако при насыщении льда фтором при -400С образуется соединение HFO
(Возможны также реакции: 2HFO  2HF + O2; HFO + H2O
2HF + O2; HFO + H2O  HF + H2O2,
HF + H2O2,
а при избытке фтора (см. 8) : F2 +HFO  OF2 + HF.)
OF2 + HF.)
Растворимость (моль/л) хлора, брома и иода в воде незначительна (табл.8), причем с повышением температуры для хлора она уменьшается, брома - практически не меняется, а иода - увеличивается.
Таблица 8.Константы равновесия реакций (250С).
| NN | Равновесие | Хлор | Бром | Иод |
| X2(газ,ж.,тв.)=X2(р-р) | 0.06 | 0.21 | 0.0013 | |
X2(р-р)+H2O = HOX + H ++
| 3.9. 10-4 | 7.2. 10-9 | 2. 10-13 | |
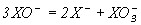
| 1027 | 1015 | 1020 | |

| 1029 | 10-33 | 10-53 |
Можно отметить два типа взаимодействия молекул воды с молекулами галогенов. К первому относится процесс образования клатратов, например, 8Cl2. 46H2O при замораживании растворов. Молекулы галогена в клатратах занимают свободные полости в каркасе из молекул H2O, связанных между собой водородными связями.
Ко второму типу можно отнести гетеролитическое расщепление и окислительно-восстановительное диспропорционирование
 (реакция 2,табл.8):
(реакция 2,табл.8):
(Механизм реакции диспропорционирования включает поляризацию молекулы хлора молекулой H2O, образование промежуточного соединения и последующую его диссоциацию с образованием Cl--:

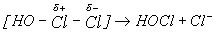
Константы этого равновесия для Х = Cl, Br, I малы (табл.8), особенно для Х = Br, I , поэтому бром и иод при растворении в воде остаются преимущественно в молекулярной форме Br2 и I2.
Состав продуктов взаимодействия галогенов с водой зависит от рН, возможности выведения из сферы реакции конечных или исходных веществ, констант равновесия и скоростей реакций диспропорционирования гипогалогенитов.
Равновесие 2 (табл.8) можно сместить вправо добавлением щелочных реагентов, например, Na2CO3:
Cl2 + Na2CO3 + H2O = NaHCO3 + NaCl + HClO ,
а также добавлением суспензий оксидов ртути (II) или висмута Bi2O3 для перевода в осадок хлорид-ионов:
Cl2 + 2HgO + H2O = HgO . HgСl2  + 2HClO, 2 Cl2 + Bi2O3 + H2O = 2BiOCl
+ 2HClO, 2 Cl2 + Bi2O3 + H2O = 2BiOCl  + 2HClO.
+ 2HClO.
Приведенные реакции используют для получения HClO, HBrO, HIO.
Диспропорционирование гипогалогенит-ионов термодинамически наиболее вероятно до галогенид- и галогенат-ионов (реакция 3, табл.8). Скорости реакций и, значит, состав продуктов взаимодействия галогенов с водой существенно зависят от температуры. Несмотря на близость величин констант равновесия реакций (3) и (4) (табл.8) для хлора, скорость первой из них существенно больше, чем второй. Как отмечалось в 9.3 , высокая энергия активации реакции (4) обусловлена повышением прочности связи и увеличением экранирования хлора в ряду  .
.
Скорость реакции (3) (табл.8) сильно зависит от температуры. Так, при действии хлора на эффективно охлаждаемый раствор щелочи образуются гипохлориты, например, жавелевая вода:
2NaOH + Cl2  NaClO + NaCl +H2O.
NaClO + NaCl +H2O.
При взаимодействии же хлора с неохлаждаемым раствором щелочи происходит разогревание раствора, и получаются хлораты, например, бертолетова соль KClO3:
6KOH + 3Cl2 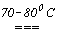 KClO3 +5KCl + 3H2O.
KClO3 +5KCl + 3H2O.
Таким образом, совокупность термодинамических и кинетических факторов обусловливает следующий состав продуктов взаимодействия в системе Cl2+H2O: растворенный в воде хлор (он преобладает), HCl, HClO, HClO3. При насыщении хлором холодной воды (0-20оС) часть молекул Cl2 диспропорционирует:
Cl2 + H2O = HCl + HClO,
при этом кислотность раствора постепенно увеличивается.
Комбинируя потенциалы Ео реакции  ;
;  = 1.36 В;
= 1.36 В;
O2 + 4H+ + 4 = 2H2O;
= 2H2O;  = 1.23 В,
= 1.23 В,
можно оценить и потенциал процесса:
Cl2 + H2O = 2HCl + О2;  .
.
Поэтому при хранении водного раствора хлора на холоду из него медленно выделяется кислород, а концентрация HClO уменьшается, причем солнечный свет ускоряет разложение. При насыщении хлором горячей воды (>20оС) растворимость хлора существенно уменьшается, а вместо HClO в растворе накапливается хлорноватая кислота HClO3.
Бром и иод взаимодействуют с водой аналогично хлору. Однако увеличение размеров атома галогена и аниона  приводит к повышению скорости диспропорционирования. Поэтому, несмотря на большое значение константы равновесия реакции (3) (табл.8), скорость этой реакции при переходе от хлора к брому и иоду существенно увеличивается (см.также 11.1). В результате ион
приводит к повышению скорости диспропорционирования. Поэтому, несмотря на большое значение константы равновесия реакции (3) (табл.8), скорость этой реакции при переходе от хлора к брому и иоду существенно увеличивается (см.также 11.1). В результате ион  в растворах можно обнаружить лишь при температурах ниже 00С. Скорость диспропорционирования иона
в растворах можно обнаружить лишь при температурах ниже 00С. Скорость диспропорционирования иона 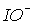 велика при любой температуре, поэтому в растворах он не существует. Кроме того, появление HХ повышает кислотность и смещает равновесие 2 (табл.8) влево. Таким образом, бром и иод при растворении в воде остаются в форме Br2 и I2.
велика при любой температуре, поэтому в растворах он не существует. Кроме того, появление HХ повышает кислотность и смещает равновесие 2 (табл.8) влево. Таким образом, бром и иод при растворении в воде остаются в форме Br2 и I2.