Первое начало термодинамики. Энтальпия
Если закрытую систему, например газ в цилиндре под поршнем, нагреть, то тепло Q, подведенное к системе, расходуется на увеличение внутренней энергии (∆U) и совершения работы против внешнего давления (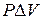 ):
):
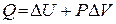
Приведенная формулировка представляет собой выражение первого начала термодинамики, а формула – его математическое выражение.
Если реакция протекает при постоянном объеме (∆V = 0, изохорный процесс), то работа расширения системы равна нулю и поглощенная системой теплота (тепловой эффект реакции) затрачивается на изменение внутренней энергии. Таким образом, при изохорном процессе тепловой эффект реакции равен изменению внутренней энергии системы. Qv = ∆U.
Большинство химических реакций протекает при постоянном давлении
(∆Р = 0, изобарный процесс). В этом случае тепло, подведенное к системе, расходуется на увеличение внутренней энергии (газ нагреется) и на совершение работы против внешнего давления (поршень поднимется). Раскроем формулу
Q = ∆U + P∆V .
Q = (U2 – U1) + P(V2 – V1);
Q = (U2 + PV2) - (U1 + PV1).
(U + PV) обозначим через H. Н – энтальпия. Тогда
Qp = H2 – H1 = 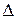 H; Qp = ∆H
H; Qp = ∆H
Таким образом, тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы. При экзотермической реакции энтальпия системы уменьшается и ∆H < 0, а при эндотермической энтальпия системы увеличивается и ∆H > 0. Измеряется энтальпия в кДж.
Изменение энтальпии принято относить к тому случаю, когда все исходные вещества и продукты реакции находятся в стандартном состоянии. Стандартным состоянием вещества при данной температуре называется его агрегатное состояние в виде чистого вещества при давлении 101,325 кПа. Условия, при которых все участвующие в реакции вещества находятся в стандартном состоянии, называются стандартными условиями. Отнесенные к стандартным условиям изменения соответствующих величин называются стандартными изменениями и их обозначения снабжаются верхним индексом. Например, ∆H0 – стандартная энтальпия.
Стандартная энтальпия реакции образования 1 моль сложного вещества из простых веществ называется стандартной энтальпией образования. Обозначается ∆fН0, измеряется в кДж / моль, является справочной величиной. ∆fН0 простых веществ равна нулю.
Уравнения химических реакций, в которых указаны изменения энтальпии,называются термохимическими уравнениями. Например, термохимическое уравнение
СаО(К) + Н2O(Ж) = Са(ОН)2(К), ΔН0 = - 653 кДж
показывает, что при взаимодействии 1 моль СаО и 1 моль воды образуется 1 моль Са(ОН)2 и выделяется количество теплоты, равное 653 кДж.
Особенности термохимических уравнений: 1) указывается агрегатное состояние веществ; 2) коэффициенты могут быть дробными.
Н2(г) + 1/2О2(г) = Н2О(ж), ΔН0 = - 285,8 кДж
Н2(г) + 1/2О2(г) = Н2О(г), ΔН0 = - 241,8 кДж
Определение тепловых эффектов может быть осуществлено опытным путем с помощью калориметра или путем вычислений. В основе термохимических расчетов лежит закон Гесса:тепловой эффект химической реакции (т. е. изменение энтальпии ΔН) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Часто в термохимических расчетах применяют следствиеиз закона Гесса:энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ.
∆Н0хр = Σ∆fН0 продуктов реакции - Σ∆fН0 исходных веществ
Например, стандартная энтальпия реакции nА + mВ == рС + qD рассчитывается по формуле
ΔН0х..р = ( р ∆fН0 С + q ∆fН0 D) - ( n ∆fН0 А + m ∆fН0B ),
где ∆fН0 - стандартная энтальпия образования соединения.