Стандартная изотерма Вант – Гоффа.
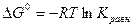
Пример термодинамического расчёта химической реакции:

Возможно ли при стандартных условиях самопроизвольное протекание процесса?
DG° = DH° - TDS°
| Вещества | 
| 
|
| CaCO3(к) | -1207 | 88,7 |
| CaO(к) | -635 | 39,7 |
| СО2(г) | -393,5 | 213,7 |
По 2-ому следствию закона Гесса:
 = + 178,5 (кДж).
= + 178,5 (кДж).
DH > 0.
 = 164,7
= 164,7 .
.
DS > 0.
DG° = DH° - TDS° = 178,5 – 298×164,7×10-3 = 129,6 (кДж).
DG > 0.
Выводы:
1. DH>0, процесс эндотермический, энтальпийный фактор против самопроизвольности процесса.
2. DS>0, система стремится к беспорядку, энтропийный фактор за самопроизвольность процесса.
3. DG>0, при стандартных условиях невозможно самопроизвольное протекание процесса.
Вопрос: при каких условиях возможно протекание процесса?
Вычислим температуру равновесного состояния:
DG = 0 Þ DН - TравнDS = 0 Þ DН = ТравнDS,
 , при Т > 10840K, DG<0, следовательно, данный процесс может протекать при температурах выше 10840К
, при Т > 10840K, DG<0, следовательно, данный процесс может протекать при температурах выше 10840К