Термохимия
Все химические процессы протекают либо с выделением, либо с поглощением тепла. Экзотермическими называют процессы, идущие с выделением тепла и эндотермическими – идущие с поглощением тепла. Количество выделяемой или поглощаемой теплоты называется тепловым эффектом реакции.
Для изохорных процессов тепловой эффект равен изменению внутренней энергии:  , для изобарных – изменению энтальпии:
, для изобарных – изменению энтальпии: , т. е. тепловой эффект не является функцией состояния системы, т.к. зависит от условий проведения реакции.
, т. е. тепловой эффект не является функцией состояния системы, т.к. зависит от условий проведения реакции.
Химические уравнения, в которых указан тепловой эффект реакции при постоянном давлении и температуре, называются термохимическими уравнениями. Причём, в термодинамике все процессы рассматриваются со стороны самой системы: тепловой эффект считается положительным (DН > 0) для эндотермических процессов и отрицательным (DН < 0) для экзотермических процессов.
Тепловой эффект реакции при постоянном давлении (DН) измеряется в кДж, и относится к числу молей веществ, участвующих в реакции. Кроме того, в термохимических уравнениях указывают агрегатное состояние веществ, участвующих в реакции.
Энтальпия реакции приводится для стандартных условий: температуры 298°К и давления в 1 атм. = 101325 Па.
Изменение энтальпии может быть найдено не только для химических реакций, но и для других процессов – например, фазовых переходов. Фазовым переходом называют переход одной фазы в другую: твёрдое – жидкое (испарение), твёрдое – газ (сублимация или возгонка) и т. д.
Стандартная энтальпия образования сложного вещества - это тепловой эффект реакции образования 1-го моля сложного вещества из простыхвеществ.
Стандартная энтальпия разложения сложного вещества - это тепловой эффект реакции разложения 1-го моля сложного вещества на простые вещества.
Стандартная энтальпия образования 1-го моля сложного вещества равна стандартной энтальпии разложения 1-го моля вещества, взятого с обратным знаком – закон Лавуазье-Лапласа.
 , где
, где 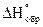 ,
,  - энтальпии образования (разложения) сложного вещества при стандартных условиях.
- энтальпии образования (разложения) сложного вещества при стандартных условиях.
Энтальпия образования 1-го моля вещества приводится в таблицах и измеряется в  . Энтальпии образования простых веществ равны нулю.
. Энтальпии образования простых веществ равны нулю.
Основной закон термохимии (закон Гесса).
Тепловой эффект химической реакции не зависит от пути проведения процесса, числа и вида промежуточных стадий, а зависит только от начального и конечного состояния реагирующих веществ, при условии постоянства давления или постоянства объёма.
1-ое следствие закона Гесса. Тепловой эффект процесса равен сумме тепловых эффектов промежуточных стадий.

2-ое следствие закона Гесса.Тепловой эффект процесса равен алгебраической разности между суммой теплот образований продуктов реакции и суммой теплот образования исходных веществ, причём коэффициенты в уравнении учитываются как сомножители теплот образований.
сС + dD = аА + bВ;
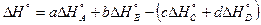 ;
;

Пример расчёта теплового эффекта химической реакции:
 ; DН = ?
; DН = ?
| Вещество | ΔН0298, кДж/моль |
| NH3(г) | -46,2 |
| О2(г) | |
| Н2О(ж) | -285,8 |
| NO(г) | 90,3 |
 =
=
=  кДж.
кДж.