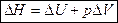Первый закон химической термодинамики.
Основные понятия и определения химической термодинамики.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Первый закон термодинамики
Химическая термодинамика представляет собой научную дисциплину, которая изучает:
- переход энергии из одной формы в другую, от одной части системы к другой;
- тепловые эффекты, сопровождающие химические и физические процессы;
- возможность и направление самопроизвольного протекания процессов.
Система – это вещество или смесь веществ, мысленно или фактически выделенных из окружающей среды.
Системы бывают:
- открытыми – могут обмениваться с окружающей средой и веществом и энергией;
- закрытыми – могут обмениваться с окружающей средой только энергией;
- изолированными – не могут обмениваться с окружающей средой ни веществом, ни энергией.
С другой стороны, системы бывают гомогенными и гетерогенными. В гомогенных системах вещества находятся в одной фазе, в гетерогенных – в разных фазах, т.е. в гетерогенных системах существуют поверхности раздела.
Фаза – часть системы, отделённая от других её частей поверхностью раздела, при переходе через которую свойства меняются скачком.
Свойства системы называются параметрами состояния системы.
Параметры интенсивности не зависят от количества вещества (температура, давление, плотность), параметры экстенсивности зависят от количества вещества (масса, объём, площадь поверхности раздела).
Любое изменение одного или нескольких параметров называется переходом системы из одного состояния в другое или процессом.
Процессы бывают:
- изотермические, при постоянной температуре (T = const.);
- изохорные, при постоянном объёме (V = const.);
- изобарные, при постоянном давлении (Р = const.).
Состояние системы бывает равновесным и стационарным. При равновесном состоянии соблюдается постоянство всех параметров при отсутствии обмена с окружающей средой веществом или энергией, при стационарном - все параметры остаются постоянными, но при этом наблюдается обмен веществом или энергией с окружающей средой.
Цикл – цепь последовательных превращений, при которых все параметры системы возвращаются к исходным значениям.
Первый закон химической термодинамики представляет собой в наиболее общем виде закон сохранения энергии для систем, в которых изменение энергии происходит в виде теплоты и работы.
Для любого процесса соблюдается равенство: Q = ΔU + A
Формулировка 1-ого закона химической термодинамики:
Если к системе подводится теплота, то она расходуется на изменение внутренней энергии системы и совершение системой работы.
U – внутренняя энергия. Под внутренней энергией подразумевается общий запас энергии, включая энергию межмолекулярного взаимодействия в среде, энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов и других частиц, за исключением кинетической и потенциальной энергии системы в целом.
Внутренняя энергия системы это функция состояния вещества, её изменение не зависит от пути перехода из одного состояния в другое.
Абсолютное значение внутренней энергии определить невозможно, можно определить только её изменение(DU).
В термодинамике обычно исследуют две формы передачи энергии от одной системы к другой – теплоту и работу.
Теплота (Q) – микроскопическая форма передачи энергии при столкновении хаотически движущихся молекул и атомов соприкасающихся тел.
Под работой (А) подразумевается работа системы против внешних сил (давления, электрических и магнитных полей и др.)
В отличие от внутренней энергии, работа и теплота не являются функциями состояния системы, они зависят от вида процесса.
Если система переходит из одного состояния характеризуемого объёма V1 в другое, с объёмом V2 то:
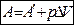 , где А¢ - работа против всех сил, действующих на систему, кроме внешнего давления. рDV – работа расширения системы.
, где А¢ - работа против всех сил, действующих на систему, кроме внешнего давления. рDV – работа расширения системы.
Если изучаемая система находится только под действием давления, то A = рDV, тогда 1-ый закон термодинамики имеет вид: 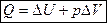 .
.
1) Для изохорных процессов (V=const, ΔV=0):
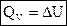 , т. е. теплота расходуется только на изменение внутренней энергии.
, т. е. теплота расходуется только на изменение внутренней энергии.
2) При постоянном давлении (изобарные процессы):
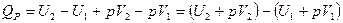
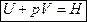 , где Н – энтальпия (теплосодержание системы), т. е.
, где Н – энтальпия (теплосодержание системы), т. е.
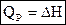
Энтальпия– функция состояния системы, она не зависит от пути перехода системы из одного состояния в другое. Абсолютное значение энтальпии определить невозможно, можно определить только её изменение. В термохимии изменение энтальпии называют тепловым эффектом реакции.
Энтальпия процесса